Пульс-терапия – это введение высоких доз метилпреднизолона (чаще всего) для быстрого подавления иммунной реакции и воспаления. Используется при крайне тяжелом течении ревматических болезней (красная волчанка, ревматоидный артрит), острой травме спинного мозга, пересадке органов. Классическая схема: по 1000 мг метилпреднизолона (Метипред, Солу-Медрол) внутривенно капельно за 60 минут на 250 мл физраствора 3 дня подряд.
Осложнения чаще всего ограничиваются мышечной болью, покраснением лица, горечью во рту и нарушением сна. Из-за риска серьезных последствий (стероидная язва, повышение давления и сахара в крови, судороги) пульс-терапия проходит только в стационаре. Ее эффект сохраняется от 4 до 12 недель. Для восстановления организма назначают препараты: Панангин, Глицирам, витамины группы В, аскорбиновую кислоту.
А пока давайте поговорим про Рассеянный склероз.
От использования лекарства необходимо отказаться при диагностировании:грибкового поражения кожного покрова;воспаления роговицы глаза.
Запретом становится индивидуальная непереносимость препарата.
Среди недостатков средства стоит выделить более значительное подавление процессов продуцирования кортикостероидов надпочечниками больного, что приводит к увеличению длительности поддерживающего курса Преднизолоном.
Поддерживающая терапия при рассеянном склерозе назначается лечащим врачом (неврологом) после масштабного сбора анамнеза.
Схемы лечения при РС выстраиваются индивидуально, в зависимости от характера течения заболевания, выраженности сопутствующих симптомов и т.п.
Профилактика
Предварительные данные свидетельствуют о том, что люди с высоким уровнем циркулирующего витамина D имеют более низкий риск РС. Поэтому, добавление витамина D может снизить риск развития РС и превращения первого клинического события в клинически определенную форму болезни. Витамин D может также снизить частоту рецидивов у пациентов с ремиттирующим РС.
По данным Института медицины, для здоровых людей концентрации витамина D в сыворотке 20-50 нг/мл обычно считаются достаточными для здоровья костей и общего здоровья. Концентрация витамина D в сыворотке крови 30-40 нг/мл была предложена как оптимальная для профилактики РС.
Достижение этих уровней может потребовать использования дополнительного витамина D в дозах до 3000 МЕ в день. Поддержание же этих уровней требует доз от 500 до 800 МЕ в день. Однако безопасность и эффективность приема витамина D среди пациентов с РС остается неясной.
Раннее лечение иммуномодулирующими препаратами было связано с уменьшением прогрессирования инвалидности и снижением частоты вторичных рецидивов. Однако пациенты с РС должны понимать, что современные иммуномодулирующие препараты нельзя считать лечебными.
Как работает Дексаметазон
Для рассеянного склероза типично замедление процессов передачи нервных импульсов, что обусловлено разрушением окружающей нерв оболочки. Прием кортикостероида препятствует высвобождению липотропных гормонов и АТКГ, но при этом стимулирует выброс в кровь арахидоновой кислоты, улучшая общее самочувствие больного.
Применение Дексаметазона при рассеянном склерозе усиливает защитные силы организма, так как препарат улучшает работу сердечно-сосудистой системы.
Симптомы обострения в среднем исчезают к концу первой недели от начала использования средства.
- закупорка кровеносных сосудов тромбами;
- аллергическая реакция;
- головные боли;
- судороги;
- нарушения сна;
- сердечная недостаточность;
- упрежение сердечного ритма;
- кожные высыпания.
Симптомы заболевания
Данный метод лечения – это хороший способ избавления от надоевших болячек, если они действительно имеются. Для того, чтобы сделать первый шаг к выздоровлению, обратите внимание, существуют ли у вас следующие симптомы:
- Заболевание рассеянным склерозом. При этом пациент чувствует нарушение в координации движений, ухудшения зрения или речи. Больной чувствует онемение и постоянную слабость. Ощущается вялость в конечностях, периодические спазмы мышц. Все эти ухудшения приводят к нарушению физической активности, человек начинает спотыкаться.
- Отек Квинке — аллергический. Симптомы такого злосчастья, видны сразу по истечении нескольких минут. В основном у больного, на разных участках слизистых и на лице, появляется отек. Это не простое заболевание, и требует быстрого и незамедлительного лечения. Помните, если запустить болезнь, отек может переместится на мозговые оболочки, и вызвать такие заболевания как эпилепсия.
- Астматический статус. Это бронхиальная астма. При этом больной имеет возбужденное состояние, дыхание его затрудняется, и возникает приступообразный кашель.
Если вдруг, вы обнаружите данные симптомы у себя, вам необходимо посетить врача. Лечащий доктор, обязательно порекомендует пройти курс лечения сверхвысокими и ударными дозами гормонов. Данная процедура, обладает полезным свойствами и имеет массу преимуществ.
Пульс-терапия метипредом обычно оказывает быстрое положительное воздействие на суставной синдром у больных ревматоидным артритом. Уже на 2-3 день от начала лечения наблюдается значительная регрессия полиартрита, утренней скованности, увеличивается мышечная сила и функциональная активность. К сожалению, длительность клинического улучшения после пульс-терапии недостаточно продолжительна – от нескольких дней до 2-3 месяцев. Именно по этой причине пульс-терапия у больных ревматоидным артритом нельзя рассматривать как основное, «базисное», средство лечения.
… внутривенное введение сверхвысоких, ударных доз глюкокортикостероидных гормонов.
Внутривенное введение сверхвысоких, ударных доз глюкокортикостероидных гормонов, или пульс-терапия, получило наибольшее распространение в медицине критических состояний – септический шок, астматический статус, острый инфаркт миокарда с развитием синдрома Дресслера, отек Квинке, отек мозга, синдром Лайела, рассеянный склероз и др. Стандартным считается применение пульс-терапии для профилактики и купирования криза отторжения трансплантата. Именно успешное применение пульс-терапии у больных с кризом отторжения, в основе которого лежит целый ряд иммунных нарушений, послужило основой для использования пульс-терапии у больных с аутоиммунными ревматическими заболеваниями.
Патофизиологическим обоснованием для применения ударных доз глюкокортикоидов является их способность активно взаимодействовать с системой иммунитета и подавлять воспалительные реакции. Одним из важнейших эффектов пульс-терапии является подавление активности нейтрофилов и моноцитов и способность вызывать транзиторную перераспределительную лимфопению. Благодаря тормозящему воздействию пулс-терапии на В-лимфоциты происходит достаточно стойкое снижение продукции иммуноглобулинов с последующим уменьшением образования аутоантител и ЦИК (циркулирующих иммунных комплексов).
Противовоспалительный и иммуномодулирующий эффекты ударных доз глюкокортикоидов в значительной степени определяются воздействием на систему цитокинов. Пульс-терапия оказывает выраженное тормозящее влияние на синтез противовоспалительных интерлейкинов-1, -6, -8 (ИЛ) и фактор некроза опухоли (ФНО), подавляет транскрипцию и усиливает деградацию генов, контролирующих синтез ИЛ-2-рецептлоров, занимающих центральное место в развитии иммунного ответа, через влияние на синтез липокортина и металлопротеиназ, участвующих в механизмах разрушения хряща, реализуется антидеструктивный и противовоспалительный эффекты пульс-терапии глюкокортикоидами.
До определенного времени оставался дискутабельным вопрос о дозировках, способах введения и препарате выбора для проведения пульс-терапии. В многочисленных исследованиях 80-90-х гг. убедительно доказано, что именно внутривенное введение ударных доз обладает перечисленными выше противовоспалительными и иммуносупрессивными эффектами и значительно превосходит по эффективности пероральное назначение глюкокортикоидов в аналогичных дозировках.
Препаратом выбора до настоящего времени, безусловно, является 6-метилпреднизолон , обладающий минимальной минералокортикоидной активностью и мощным противовоспалительным и иммуномодулирующим эффектом. В отличие от других глюкокортикоидных препаратов 6-метилпреднизолон обладает сбалансированным геномным и негеномными эффектами.
Концентрация метилпреднизолона в крови пропорциональна дозе вводимого препарата, связывание с белками плазмы носит линейный характер, 77% связывается с альбумином. Длительность действия метилпреднизолона составляет 24-72 часа после инфузии, через 24 часа 99% препарата выводится, и длительность эффекта обеспечивается влиянием на функцию лимфоцитов. Иммуносупрессивная и противовоспалительная активность пульс-терапии зависит от дозы, так внутривенное введение 1000 мг метилпреднизолона и более приводит к взаимодействию со всеми глюкокортикоидными рецепторами, их перезагрузке и экспрессии, что повышает эффективность лечения.
Преднизолон , как средство для проведения пульс-терапии, уступает по клинической эффективности метипреду (метилпреднизолону) в несколько раз, не обладает столь выраженным иммуномодулирующим эффектом и часто вызывает такие негативные минералокортикоидные эффекты, как задержка жидкости и артериальная гипертензия. Дексаметазон способен оказывать быстрый и выраженный антиаллергический эффект. Его назначение может быть целесообразным у больных с аллергическим васкулитом и поражением центральный нервной системы, сопровождающимся отеком мозга.
«Классической» методикой проведения пульс-терапии является внутривенное введение метипреда, ежедневно, в течение 3 последовательных дней, из расчета 15-20 мг на 1 кг веса больного в день (или 1000 мг на 1 м2 поверхности тела), что составляет в эквиваленте около 1200 мг преднизолона внутрь. Препарат разводят в 100-250 мл 0,9% изотонического раствора натрия хлорида или 5% раствора глюкозы и вводят в течение 35-45 минут. Более медленное введение существенно снижает клиническую эффективность, в основном за счет снижения иммуносупрессивного эффекта. Быстрое введение, за 10-15 минут, может привести к тяжелым осложнениям, вплоть до развития острой сердечной недостаточности.
Более медленное введение (около 3 часов) с уменьшением дозы до 10 мг на 1 кг веса целесообразно у больных с сердечно-сосудистой патологией. Только в случае наличия показаний в капельницу добавляют гепарин (у больных с ДВС-синдромом, тромбозом), седативные препараты, панангин и сердечные гликозиды. Стимуляция фуросемидом через 15-20 минут после пульс-терапии допускается только в случае анурии или олигоанурии.
Комбинированное применение пульс-терапии метипредом и циклофосфаном состоит из классической 3-дневной пульс-терапии с добавлением циклофосфана во 2-й день, из расчета 15-20 мг/кг веса больного (или 1000 мг на м2 поверхности тела). Циклофосфан разводят в одном флаконе с метипредом в физиологическом растворе или глюкозе и вводят внтривенно капельно в течение 35-45 минут. Для уменьшения токсического воздействия циклофосфана возможно назначение боль ному обильного питья. В ряде случаев 1000 мг метипреда и 1000 мг циклофосфана назначается ежемесячно.
Побочные явления пульс-терапии метилпреднизолоном обычно ограничиваются тахикардией и гиперемией лица, которые в той или иной степени наблюдаются у большинства больных как непосредственно во время инфузии, так и несколько часов спустя (в редких случаях до 2 суток). У подростков и у лиц с предрасположенностью к тахикардии профилактически назначается седативные средства (например, оксазепам 5-10 мг). Тахикардия обычно легко купируется назначением 50 мг атенолола.
Значительно более редкими побочными эффектами являются эмоциональное возбуждение (бессонница), брадикардия и гипотония. Назначение седативных и снотворных препаратов быстро приводит к нормализации эмоционального статуса и сна. Брадикардия и гипотония наблюдаются не более чем в 1-2% случаев проведения пульс-терапии и обычно отмечаются во время инфузии метилпреднизолоном или в первые 1,5-2 часов после ее окончания. При первых симптомах развития гипотонии и брадикардии – слабости, головокружения, тошноты, нарушения зрения, необходимо немедленно начать терапию кардиотониками, в тяжелых случаях применять дексаметазон (от 16 до 40 мг внутривенно).
Среди осложнений пуль-терапии на первом месте стоит частое развитие интеркуррентных инфекций (бактериальных и вирусных), обычно наблюдается у ослабленных больных, при тяжелом обострении СКВ, при программном назначении пульс-терапии в комбинации с циклофосфаном. реальной профилактики не существует. Однако больные должны быть информированы о возможности развития инфекций и принять меры, направленные на предотвращение инфицирования. Икота очень редко наблюдается после проведения пульс-терапии, однако в некоторых случаях может приобретать затяжной характер (от нескольких часов до нескольких суток), купируется подкожным введением атропина. Артрит коленных суставов, обычно коленных, наблюдается менее чем у 1% больных. артрит, как правило, развивается через несколько часов, реже суток, после инфузии, купируется назначением 100-150 мг индометацина или диклофенака.
Анафилаксия и внезапная смерть описаны в литературе как единичные случаи. Профилактикой анафилаксии является тщательный сбор аллергологического анамнеза, при ее развитии производят незамедлительное внутривенное введение 16-40 мг дексаметазона, норадреналина. Известны несколько случаев внезапной смерти больных, получавших пульс-терапию. летальный исход наблюдается на фоне развившейся желудочковой аритмии, которая, вероятно, была обусловлена острыми метаболическими нарушениями в миокарде.
Не рекомендуется назначение пулс-теапии при развитии ИБС, сердечной недостаточности, тяжелых аритмий и неконтролируемой артериальной гипертензии. С особой острожностью необходимо проводит пульс-терапию у лиц пожилого и старческого возраста. Для уменьшения риска кардиальных осложнений запрещается проведение пульс-терапии и петлевых диуретиков – фуросемида.
На фоне пульс-терапии с целью профилактики ульцерогенного действия обязательно назначение антацидных средств, блокаторов Н2-гистаминовых рецепторов, для профилактики гипокалиемии — препаратов калия, калийсберегающих диуретиков, для профилактики вторичных бактериальных осложнений — антибактериальных препаратов. В связи с возможным развитием побочных действий пульс-терапии (периферических отеков, глюкозурии, нейропсихических нарушений, дискомфорта в желудке, инфекционных заболеваний кожи и мочеполовой системы, эпилептических припадков, колебаний артериального давления) рекомендуем ее проведение в условиях стационара, под наблюдением специалиста в течение 3-7 дней, дальнейшая терапия может проводиться амбулаторно. После окончания курса кортикостероидов рекомендуем прием препаратов, стимулирующих выработку собственных стероидов надпочечниками, — глицирам 0,05-0,1 от 2 до 6 раз в день за 30 минут до еды или сироп (или отвар) солодки длительностью от 3 до 6 месяцев.
Рассмотрим применение пульс-терапии при ревматоидном артрите и рассеянном склерозе.
Пульс-терапия у больных с ревматоидным артритом. Основным показанием для назначения пульс-терапии у больных ревматоидным артритом является развитие системных проявлений или так называемого ревматоидного васкулита. Появление стойкого лихорадочного синдрома, ревматоидных узелков, потери веса и прогрессирующей амиотрофии, распространенной лимфаденопатии – является веским основанием для назначения «классической» пульс-терапии. Трехдневная пульс-терапия метипредом высокоэффективна у больных с синдромом Стилла у взрослых и при синдроме Фелти. Выявление у больных ревматоидным артритом дигитального васкулита, выраженных сосудистых и трофических расстройств (язвы нижних конечностей, гангрена), полинейропатии и нефрита, требует проведения комбинированной пульс-терапии метипредом и циклофосфаном.
Пульс-терапия метипредом обычно оказывает быстрое положительное воздействие на суставной синдром у больных ревматоидным артритом. Уже на 2-3 день от начала лечения наблюдается значительная регрессия полиартрита, утренней скованности, увеличивается мышечная сила и функциональная активность. К сожалению, длительность клинического улучшения после пульс-терапии недостаточно продолжительна – от нескольких дней до 2-3 месяцев. Именно по этой причине пульс-терапия у больных ревматоидным артритом нельзя рассматривать как основное, «базисное», средство лечения.
Однако назначение пульс-теаприи у больных ревматоидным артритом с преимущественным поражением суставов может быть целесообразным в случае прогрессирующего течения и неэффективности базисных средств и НПВП. У больных с торпидным течением, быстрым прогрессированием деструкций суставов и неэффективностью (непереносимостью) базисных средств обоснованным представляется назначение комбинированной терапии с использованием плазмафереза, пульс-теаприи и больших доз метотрексата (20-40мг) внутривенно.
Пульс-терапия у больных с рассеянным склерозом. Основным стандартным методом терапии тяжелых обострений рассеянного склероза признано использование схем внутривенного введения кортикостероидов в пульс-дозах, что убедительно подтверждено рандомизированными исследованиями с использованием двойного слепого метода и результатами динамически проведенной МРТ, причем длительность обострений и выраженность остаточного неврологического дефицита зависят от своевременного проведенного курса именно такой терапии. Назначая кортикостероиды, прежде всего рассчитывают на мощное противоотечное, противовоспалительное и мембраностабилизирующее действие. Поэтому их использование целесообразно тогда, когда обострение проявляется тяжелыми симптомами (поражения спинного мозга, ствола мозга, мозжечка) и быстрое купирование отека и воспаления может способствовать более полному регрессу симптомов.
МРТ признана одним из основных методов постановки как диагноза, так и критериев в выборе тактики терапии, контроля за лечением. Однако в ряде случаев степень выраженности клинического обострения РС по данным МРТ не подтверждается появлением новых очагов или увеличением старых, накапливающих контраст, что, видимо, связано с декомпенсацией старых очагов и нарушением проведения импульса из-за неспецифических изменений гомеостаза. Применение в таких ситуациях кортикостероидов в пульс-дозах приводит к феномену быстрого клинического улучшения. Поэтому считаем, что в выборе тактики терапевтического воздействия при рассеянном склерозе все же ведущей должна оставаться степень тяжести клинических проявлений, а данные МРТ — только дополнительными.
В случае же нерезко выраженных признаков обострения рассеянного склероза, но с выявленим «активных» очагов на МРТ, накапливающих контраст (магневист), либо появление дополнительных очагов при исследовании вызванных потенциалов являются абсолютным показанием для проведения пульс-терапии с переходом после окончания ее на препараты с нейропротекторным действием, а лучше на препараты пролонгированной модифицирующей терапии. Не количество очагов является основополагающим для проведения интенсивной терапии, а подтверждение активности очагов демиелинизации. Достаточно одного демиелинизирующего очага, но активного и плюс выраженная клиника — и это уже основание для проведения кортикостероидной пульс-терапии.
Метилпреднизолон (метипред, солу-медрол) вводится по 500-1000 мг в 200-400 мл физраствора в/в капельно по 25-30 капель в минуту 1 раз в день в первой половине суток, 3-7 дней в зависимости от тяжести обострения. Использование дозы 1000 мг мы рекомендуем больным с выраженными поражениями ствола мозга, атаксией, потерей зрения. При преобладании нарушений пирамидной и чувствительной сферы препарат показан в суточной дозе 500 мг. Увеличение инвалидизации по шкале EDSS даже в одной из оцениваемых систем более чем на 1 балл, даже в виде моносимптома (например, снижение слуха, атаксия, парез лицевого нерва), требует обязательного проведения пульс-терапии.
Солу-Медрол(Метилпреднизолон (Methylprednisolone)) — синтетический аналог гормона коры надпочечников (глюкокортикоид), который обладает противовоспалительной, иммуносупрессивной (подавляющей иммунитет) активностью, влияет на углеводный и белковый обмен. Больнымрассеянным склерозом он назначается в высоких дозах, внутривенно с целью лечения тяжелых обострений заболевания.
Солу-Медрол(Метилпреднизолон (Methylprednisolone)) — синтетический аналог гормона коры надпочечников (глюкокортикоид), который обладает противовоспалительной, иммуносупрессивной (подавляющей иммунитет) активностью, влияет на углеводный и белковый обмен. Больнымрассеянным склерозом он назначается в высоких дозах, внутривенно с целью лечения тяжелых обострений заболевания.
И с точки зрения клинической эффективности, и по отзывам пациентов пульс-терапию Солу-Медролом в период лечения обострения можно назвать в большинстве случаев чудодейственной. Действительно, за короткий промежуток времени происходит если не полное , то, по крайней мере, весьма ощутимое восстановление утраченных функций. Однако, не будем скрывать, что у фармакологического действия препарата есть и обратная сторона: побочные действия, которые, порой, доставляют весьма значительные неудобства. Их список может впечатлить и «бывалых РС-ников».
Перечислять все побочные эффекты, которые могут проявить себя в период (и после) терапии Солу-Медролом наверняка нет смысла, остановимся на наиболее часто встречающихся: увеличение массы тела, акне, остеопороз и тревожность.
Преимущества использования кортикостероидов в качестве пульс-терапии:
Схема лечения
Общая продолжительность лечения Дексаметазоном при обострении рассеянного склероза составляет от 10 суток до 6 недель и проводится в соответствии с разработанной схемой.
Начало всегда стандартное и представляет собой 5 – 10-дневный курс приема высоких доз кортикостероида в формате уколов в сочетании с приемом таблеток – это так называемая пульс-терапия или пульсотерапия.
Как колоть уколы Дексаметазона при рассеянном склерозе? Препарат используется по определенной схеме, предназначен для медленного внутривенного, капельного либо внутримышечного (редко) введения. Действовать начинает через 5 – 10 минут после инъекции.
Схема уколов Дексаметазона при рассеянном склерозе приведена в протоколе ведения пациентов «Рассеянный склероз» (утверждена в 2005 году замминистра здравоохранения). Выглядит следующим образом (в течение 1…8 дней препарат 4 раза в сутки вводят внутривенно струйно либо капельно):1…4 день – 16…40 мг/сутки;5…8 день – 8…20 мг/сутки.
В период с 9 по 12 день больной получает Дексаметазон внутримышечно в дозировке 4…12 мг до 3 раз в день.
Начиная с 13 дня лекарство, либо полностью отменяется, либо практикуется постепенное уменьшение дозы на 4 мг через день.
Проведенные исследования показали, что реализация пульс-терапии Дексаметазоном помогает быстро снять патологическую симптоматику обострения рассеянного склероза.
Причины развития заболевания
Точно неизвестно почему развивается рассеянный склероз — причины атак на миелиновую оболочку нервов не установлены. Вполне вероятно, что несколько факторов действуют совместно, чтобы вызвать или закрепить заболевание. Было выдвинуто предположение, что РС возникает, когда агент или событие окружающей среды (например, вирусная или бактериальная инфекция, воздействие химических веществ, отсутствие воздействия солнца) действует в сочетании с генетической предрасположенностью к иммунной дисфункции.
Генетические и молекулярные факторы
Для членов семьи первой степени (детей или братьев и сестер) людей, страдающих рассеянным склерозом, риск развития расстройства в семь раз выше, чем в общей популяции.
Различные варианты генов, обычно встречающиеся в общей популяции, обычно называемые полиморфизмами, могут приводить к различным градациям клеточной экспрессии этих генов и, следовательно, белков, которые они кодируют. На сегодня однако, только хромосомный локус HLA-DRB1 был последовательно связан с восприимчивостью к MS. Множество других полиморфизмов, которые могут действовать совместно с предрасположенностью к РС, были описаны с использованием общегеномных подходов, но их индивидуальный вклад в риск не так высок, как риск, связанный с локусом HLA.
Молекулярная мимикрия была предложена как этиологический процесс при РС. Гипотеза молекулярной мимикрии относится к возможности того, что Т-клетки в периферической крови могут активироваться для атаки чужеродного антигена, а затем ошибочно направлять свою атаку на белки мозга, которые имеют сходные признаки.
Вирусная инфекция
Вирусная гипотеза состоит в том, что вирус может заразить иммунную систему, активируя миелинреактивные Т-клетки, которые в противном случае оставались бы в покое. Вирус, который заражает клетки иммунной и нервной систем, возможно, может периодически реактивироваться и, таким образом, приводить к острым обострениям при РС.
Обнаружено, что инфекция вирусом Эпштейна-Барра (EBV) периодически реактивируется, но возможную причинную роль при РС трудно доказать.
Относительные, подтверждающие наличие инфекции EBV как этиологического фактора, включают:
- долгосрочные исследования, показывающие более высокую связь с РС у лиц с ранним присутствием сывороточных антител EBV;
- высокую экспрессию антигенов EBV в бляшках MS.
Доказательства, которые приводят доводы против этиологической роли инфекции EBV, включают в себя тот факт, что РС — неоднородное заболевание. Кроме того, возможно, что реактивация EBV лишь следствие, а не причина болезни.
Факторы окружающей среды
Заболеваемость этой болезнью ниже в экваториальных регионах мира, чем в самых южных и самых северных регионах. Однако градиент широты стал ослабевать после 1980 года, по-видимому, из-за возросшей заболеваемости МС в более низких широтах.
Если человек живет в области с низким уровнем заболеваемости РС до возраста 15 лет, риск этого человека остается низким, даже если он впоследствии переезжает в район с высоким уровнем заболеваемости. С другой стороны, некоторые этнические группы (например, эскимосы), несмотря на то, что живут в районах с более высокой заболеваемостью, не имеют высокой частоты РС. Следовательно, точная роль географии и генетики не ясна.
Уровень витамина D
Низкие уровни витамина D были предложены в качестве одного из факторов окружающей среды, способствующих развитию РС. Витамин D играет роль в регуляции иммунного ответа, уменьшая выработку провоспалительных цитокинов и увеличивая выработку противовоспалительных цитокинов. Кроме того, высокий уровень циркулирующего витамина D, по-видимому, связан со сниженным риском рассеянного склероза.
Таким образом, более низкие уровни витамина D из-за более низкого воздействия солнечного света в более высоких широтах могут быть одной из причин географических вариаций заболеваемости рассеянным склерозом. А защитный эффект традиционных диет с высоким содержанием витамина D может помочь объяснить, почему определенные районы (например, Норвегия) показывают низкую заболеваемость РС, несмотря на ограниченное количество солнечного света.
Хроническая цереброспинальная венозная недостаточность
Спорная гипотеза предлагает сосудистую, а не иммунологическую причину для некоторых случаев РС. В 2008 году Паоло Замбони описал связь между РС и хронической цереброспинальной венозной недостаточностью (CCSVI).
Гипотеза CCSVI утверждает, что стеноз основных путей экстракраниального венозного оттока приводит к нарушенному дренажу и высокому уровню мозгового венозного рефлюкса. Гипотеза CCSVI была связана с потенциальными эффектами отложения железа в паренхиме головного мозга, что, как предполагают некоторые авторы, становится прогнозом прогрессирования инвалидности, накопления объема поражения и атрофии у некоторых пациентов с РС.
Противопоказания, вероятные побочные эффекты, симптомы передозировки
• замедлить темпы прогрессирования болезни;• добиться замедления скорости инвалидизации;• уменьшить длительность, количество и степень тяжести обострений;• количественно уменьшить очаги демиелинизации (исследования подтверждены результатами магнитно-резонансной томографии).
1. Первая линия ― авонекс, ребиф, копаксон, бетаферон (производные бета-интерферона).2. Вторая линия ― финголимод, тизабри, митоксантрон. Более эффективны по сравнению с первой линией, но обладают большим спектром побочных явлений. Эффективность прохождения терапевтического курса достигается в течение полугода.
Алемтузумаб
Спонсор исследований: Washington Neuropsychology Research GroupСоавторы:GenzymeНазвания исследований: CAMMS 223, CAMMS 323 — CARE-MS I, CAMMS 324 — CARE-MS IIСтадия разработки: Компания-производитель получила положительное решение Европейского медицинского агентства о регистрации препарата алемтузумаб (Лемтрада) в июле 2013 года.Название препарата: Алемтузумаб (alemtuzumab)Другие названия:Кэмпас (Campath), Лемтрада (Lemtrada)
Тип течения РС: Рецидивирующе-ремиттирующий рассеянный склероз (РС)
- Алемтузумаб — экспериментальный препарат моноклональных антител для лечения рецидивирующе-ремиттирующего рассеянного склероза. Вводится в виде внутривенной инфузии (инфузионно) в течение 3-5 дней в год.
- Алемтузумаб действует, уничтожая Т-клетки — типа лимфоцитов, участвующих в иммунном ответе при РС.
- В исследовании, проведенном в рамках III фазы КИ, алемтузумаб уменьшал количество рецидивов примерно на 50% по сравнению с бета-интерфероном 1a (Ребиф).Некоторые исследования показали, что введение алемтузумаба в некоторых случаях останавливает прогрессирование инвалидизации, а в некоторых случаях наоборот.
- На сегодняшний день выявлено два значительных побочных эффекта:
- идиопатическая тромбоцитопеническая пурпура (ИТП), заболевание, которое нарушает процессы свертываемости крови. В одном случае было ИТП оказалась фатальной.
- гиперактивность щитовидной железы (болезнь Грейвса) или нарушение функции щитовидной железы
- Производитель планирует подать заявку на получение лицензии в Европе в первом квартале 2012 года
Режим введения
Алемтузумаб вводится внутривенно инфузионно. В клинических исследования алемтузумаб вводился в течение 5 дней в первый год лечения, затем в течение 3 дней через год.
Результаты проведенных исследований
В первых клинических исследованиях алемтузумаба принимали участие как пациенты с рецидивирующим, так и с прогрессирующим типами РС. У пациентов с рецидивирующе-ремиттирующим РС, лечение алемтузумабом сократило частоту рецидивов, и замедлило нарастание инвалидизации. Замедление нарастания нвалидизации отмечалось и в течение трех лет после окончания лечения.
Тем не менее, менее оптимистичные результаты были получены в клиническом исследовании при участии 25 человек с вторично-прогрессирующим рассеянным склерозом.
МРТ в течение семи лет не показали новых очагов, сформировавшихся в головном и спинном мозге тех участников, которые получили терапию алемтузумабом, однако накопление инвалидизации у этих пациентов продолжалось.
Это привело исследователей к выводам о том, что, возможно, нечто иное, чем воспаление миелиновой оболочки является причиной прогрессирования РС.
Дальнейшие исследования были направлены на оценку эффективности и безопасности применения алемтузумаба для лечения пациентов с рецидивирующе-ремиттирующим рассеянным склерозом.
Результаты второй фазы исследований (CAMMS 223):
были опубликованы в New England Journal of Medicine в октябре 2008 года. Это исследование было включено 334 человека с активным рецидивирующе-ремиттирующим РС. В исследовании оценивалась эффективность двух различных дозировок алемтузумаба в сравнении с лечением высокой дозировкой интерферона бета-1а (Ребиф).
Результаты показали, что у участников, получавших алемтузумаб значительно реже отмечались рецидивы заболевания.
В течение трех лет 77% участников, получавших низкие дозы алемтузумаба и 84%участников, получавших высокие дозы алемтузумаба не пережили ни одного клинического обострения заболевания, по сравнению с 52% участников, получавших бета-интерферон 1а.
Результаты также показали, что по сравнению с интерфероном бета 1а, алемтузумаб снижает риск устойчивой нетрудоспособности на 71%.
Участники исследования CAMS 223 продолжали быть под наблюдением специалистов и в течение 4-го года. Данные о результатах были представлены на шестьдесят второй ежегодной конференции Американской академии неврологии апреле 2010 года.
Представленные данные демонтрировали, что у 71% пациентов, получивших алемтузумаб, не отмечалась активность заболевания в течение трех лет после последнего курса лечения.
Кроме того, около у 91% людей, получавших алемтузумаб не отмечалось нарастание инвалидизации, по сравнению с 68% людей, принимающих Rebif .
Пятилетний опыт наблюдения за участниками этого исследования были представлены на 63-й конференции Американской академии неврологии в апреле 2011 года.
По данным исследователей, у 65% участников исследования не отмечалась клиническая активность заболевания (определяемая как отсутствие рецедивов и не устойчивый рост инвалидизации измеряемый в баллах по Расширенной шкале инвалидизации) в течение четырех лет после последнего курса лечения, по сравнению с 27% больных, получавших интерферон бета-1a.
Тем не менее, участники из всех групп (т.е. как получавшие алемтузумаб, так и Ребиф), течение заболевания у которых ухудшилось в первые несколько лет, были исключены из последующих наблюдений .
Результаты двух крупных исследований III фазы КИ были обнародованы в 2011 году.
Сравнение эффективности алемтузумаба и Ребифа при рассеянном склерозе, исследование I (CARE-MS I) — 323 CAMMS
Целью этого исследования было сравнение эффективности применения низкой дозы алемтузумаба, с применением бета-интерферона1а (Ребиф)в течение двух лет
В исследовании приняли участие 581 пациент с рецидивирующим РС, ранее не получавшие превентивную терапию рассеянного склероза. Алемтузумаб снижал количество рецидивов на 55% по сравнению с интерфероном бета-1а в течение двух лет. Устойчивое накопление инвалидизации (в соответствии с оценкой по шкалеEDSS ) отмечено 8% участников, получавших алемтузумаб и у 11% участников, получавших Ребиф.
Сравнение эффективности алемтузумаба и Ребифа при рассеянном склерозе исследование II (CARE-MS II) — 324 CAMMS
Во втором этапе III фазы клинического исследования по сравнению с алемтузумаба с интерфероном-бета 1а (Ребиф) приняли участие 840 человек, у которых был по крайней мере один клинический рецидив на фоне лечения зарегистрированными препаратами превентивной терапии РС.
В ходе двухлетнего исследования, алемтузумаб снизил количество рецидивов на 49% по сравнению с бета-интерфероном 1а. Исследователи отметили снижение риска нарастания инвалидизации, измеряемого в соответствии с увеличением балла по шкале EDSS, на 42%в группе алемтузумаба.
Полные результаты исследования, как ожидается, будут представлены на ближайших крупных международных конференциях по вопросам лечения РС.
Побочные действия
Наиболее серьезными побочными эффектами, развившимся у пациентов во время лечения алемтузумабом были:
- Идиопатическая тромбоцитопеническая пурпура (ИТП) — заболевание, которое нарушает процессы свертываемости крови — было фатальным в одном случае и отмечалось у 1-3% участников.
- Нарушение функции щитовидной железы отмечалось у 20-30% участников.
В ходе исследований специалисты применяли дополнительные меря для ранней диагностики и лечения этих побочных эффектов.
Дальнейшие исследования
Сравнение воздействия лечения Кэмпасом (торговое название алемтузумаба) и Ребифом на познавательные (когнитивные) функции при рассеянном склерозе (РС)
Участники исследования CAMMS 324 будут протестированы с целью изучения влияния терапии алемтузумабом и Ребифом на изменения познавательных дисфункций при рассеянном склерозе, таких как проблемы с вниманием, скоростью мышления, памятью.
Предполагаемая дата завершения конец 2011 года. Более подробная информация об этом исследовании.
Противопоказания, вероятные побочные эффекты, симптомы передозировки
- нарушение сознания, развитие психозов, галлюцинации, дезориентация в пространстве;
- повышение АД;
- тахикардия;
- увеличение внутричерепного давления;
- тошнота, заканчивающаяся рвотой.При соблюдении рекомендаций медиков развитие передозировки полностью исключено.
Как применять и сколько времени будет длиться курс лечения Дексаметазоном при обострении рассеянного склероза, решает лечащий врач, поскольку каждый случай индивидуален.
Лично я Дексаметазон не применл, мне его не назначали, но я имею опыт применения солу-медрола и преднизолона,
об этом подробно делюсь в своем посте ЗДЕСЬ
ВЫЗДОРАВЛИВАЙТЕ
Пульс-терапия при рассеянном склерозе
Пульс-терапия при обострении рассеянного склероза более известна как лечение гормональными препаратами. Распространенные гормоны:• Метилпреднизолон.• Солу-медрол.Кортикостероиды вводятся с целью купирования симптомов при обострении (например, уменьшение спастики), замедления развития болезни при вторично-прогрессирующей и ремиттирующей формах.
Оптимальный способ введения ― внутривенно.Длительность курса лечения составляет от 3 дней до 1 недели.Дозировка корректируется в индивидуальном порядке.
• скачки кровяного давления;• инфекционные заболевания;• туберкулез;• сахарный диабет;• заболевания ЖКТ, сопровождающиеся эрозиями, язвами.
Классификация
Рецидивирующий ремиттирующий РС (RRMS) — эта форма MS характеризуется четко определенными острыми или подострыми приступами с различной степенью выздоровления, часто с полной или почти полной ремиссией на ранних стадиях. Между приступами заболевание стабильно. Около 85% начальных диагнозов рассматриваются как RRMS. Совсем недавно термин «рецидивирующая форма РС» использовался для идентификации пациентов с любой клинической формой РС, которая демонстрирует клинический рецидив.
Вторично-прогрессирующий РС (SPMS) — начинается как RRMS. SPMS характеризуется прогрессирующей нетрудоспособностью с переменной частотой, которая может сопровождаться рецидивами, незначительными ремиссиями и плато. Из людей с первоначальным диагнозом RRMS у 50% или более разовьется SPMS в течение 10 лет и у 90% в течение 25 лет.
Важно помнить, что большинство из этих цифр основаны на исследованиях, предшествующих эпохе модифицирующей терапии.
Первичный прогрессирующий MS (PPMS) — с самого начала демонстрирует устойчивые темпы прогрессирования инвалидности или случайных плато и/или незначительных ремиссий. Сейчас есть понимание, что у небольшого числа этих пациентов могут быть наложены клинические рецидивы. PPMS составляет около 15% всех диагнозов РС. Клинический изолированный синдром (CIS) — это первый эпизод неврологического события, связанного с поражением центральной нервной системы, который типичен для рассеянного склероза. Радиологически изолированный синдром (RIS) можно рассматривать как «рассеянный склероз стадии доклинических проявлений». Он определяется как поражения, типичные для РС, видимые на МРТ-сканировании, выполненном по другой причине, такой как головная боль, травма головы или др. Наблюдение за многими из этих пациентов часто демонстрирует дополнительные поражения, типичные для рассеянного склероза и/или клинического события (CIS), а затем RRMS.
Опухолевый рассеянный склероз — редкая форма, характеризующаяся опухолеподобным поражением с признаками и симптомами, подобными опухолям головного мозга. Симптомы часто отличаются от других типов РС и могут включать головные боли, изменения в мышлении, спутанность сознания, проблемы с речью, судороги и слабость. Tumefactive MS часто, но не всегда, развивается в RRMS.
Детский РС — еще одна редкая форма РС. Приблизительно 3-5% пациентов с РС выявляются в детском возрасте (до 18 лет). Диагностировать рассеянный склероз у маленьких детей трудно, потому что симптомы совпадают со многими другими состояниями и могут отличаться от рассеянного склероза у взрослых.
Мануальная терапия при рассеянном склерозе
1. Иглоукалывание — целенаправленное введение игл под кожу в определенных точках. Этот тип альтернативного лечения не имеет научного подтверждения эффективности. Предполагаемые результаты: снятие мышечных спазмов, облегчение болевого синдрома, устранение покалывания или онемения в конечностях, устранение депрессивных состояний, улучшение функционирования мочевого пузыря (при наличии проблем с мочеиспусканием).
2. Массаж ― эффективен при болях в спине, искривлении позвоночника, шейном остеохондрозе, частых мигренях, мышечном тонусе, чрезмерной усталости при постоянных физических нагрузках или тяжелой работе. Массажные техники помогают улучшить кровообращение, что благоприятно сказывается на общем самочувствии пациентов.
Чаще всего практикуют шиацу, точечный и шведский массажи. При Р.С. есть ряд противопоказаний к проведению массажей, поэтому перед началом курса следует проконсультироваться с ведущим врачом.
Первые признаки
Для многих первые признаки рассеянного склероза проявляются в том, что врачи называют клинически изолированным синдромом (CIS). Этот эпизод неврологических симптомов обычно длится 24 часа.
Существует два типа CIS:
- Монофокальный эпизод: у вас есть один симптом.
- Мультифокальный эпизод: у вас более одного симптома.
Наиболее распространенные симптомы в CIS:
Неврит зрительного нерва. Обычно затрагивается только один глаз , но в редких случаях могут прожаться оба.
Основные проявления:
- размытое зрение;
- блеклые оттенки;
- боль в глазах, особенно при движении.
Онемение и покалывание.
Основные проявления:
- ощущение удара током при движении головой или шеей. он может перемещаться по позвоночнику или в руки или ноги;
- онемение на лице;
- покалывание в ногах.
Не каждый, у кого есть CIS, заболеет РС. Вероятность выше, если есть повреждения в мозгу от потери миелина.
Биорезонансная терапия при рассеянном склерозе
Этот метод восстановления механизмов саморегуляции организма больного также относится к методикам альтернативной медицины.
Суть лечения заключается в подсоединении электродов к специальному биорезонансному аппарату. Терапия основана на запуске собственных ресурсов с помощью человеческих электромагнитных колебаний и, в частности, благодаря регулярному отслеживанию магнитного поля.
Таким образом, патологические колебания отделяют от здоровых вибраций, преобразуют в благоприятные, после чего возвращают обратно в организм.
Волновая терапия при рассеянном склерозе
Экстракорпоральная ударная терапия нацелена на излечение миофасциального синдрома. Воздействие на определенные точки происходит благодаря давлению, образованному высокоэнергетической импульсной волной.
Такие удары попадают непосредственно в заданную цель, не травмируя ткани, которые окружают точку.ЭУВП позволяет частично восстановить функцию поврежденного спинного мозга. Улучшения наблюдаются за счет восстановления нарушенной повреждениями позвоночника микроциркуляции, снятия боли, расширения капилляров, улучшения обменных процессов.
Раздражения блокируются за счет смены полярности нейронных мембран.На эффективность лечения влияет точность определения локации для волнового воздействия. В комплексе с медикаментозным лечением результативность ВТ усиливается.
Иммунная терапия при рассеянном склерозе
Иммуномодулирующая терапия при рассеянном склерозе помогает бороться с иммунопатологическими нарушениями в организме, увеличивая длительность ремиссий.
• Бета-интерферон ― максимально эффективен при вторично-прогрессирующей и ремиттирующей формах Р.С.• Ребиф ― человеческий интерферон рекомбинатного типа (бета-1а). Является природной аминокислотой, получаемой из клеток, которые изымают из яичников китайских хомяков.
• Глатирамер ацетат.
• гормональная (пульс) терапия;• плазмаферез;• цитостатики.
Лекарства для замедления прогрессирования болезни
Терапия, направленная на замедление прогрессии заболевания очень важно и требует высокой врачебной квалификации. Так как существует множество препаратов способных целенаправленно действовать на купирование болезни, очень важно знать какой комплекс препаратов будет подходить каждому пациенту.
Если врач определился с направлением терапии, в большинстве случаев начинают использовать такие замедляющие медикаменты, как:·
- Митоксантрон при рассеянном склерозе используется с целью стимулирования функциональной активности Т-супрессоров, а также препарат способен снижать секрецию противовоспалительных цитокинов. Исследования, проводимые в 2005 году, подтвердили эффективность такого препарата, как митоксантрон использующейся при рассеянном склерозе.·
- Нейромидин. Данный препарат позволяет улучшить и стимулировать проведение импульса в нервной системе и нервно-мышечную передачу. А его главная целенаправленность состоит в улучшении памяти и торможении прогредиентноого течения деменции (слабоумия).
- Лецитин при рассеянном склерозе применяется как компонент миелина, которые подвержен разрушению при течении склерозной болезни. Специалисты советуют принимать данный препарат вместе с витаминов B12, так как их взаимодействие оказывает наиболее больший эффект от терапии данного препарата.
- Иммуномодулирующий эффект оказывает такой препарат, как Интерферон бета 1б, эффект при рассеянном склерозе которого доказан многочисленными проводимыми исследованиями. Стоит только отметить, что у взрослых пациентов с ремитирующим и вторично-прогрессирующим течением заболевания, применение интерферона бета способствует снижению частоты обострения через 2 года на 35%. Также снижается тяжесть рецидивов и продлевается состояние ремиссии пациента.·
- ВМИГ при рассеянном склерозе используются для предупреждения прогрессирования заболевания. Данное лекарство от рассеянного склероза широко зарекомендовали, прежде всего, своей доступностью, а также эффективным снижением частоты ежегодных обострений.
- Витамин Д при рассеянном склерозе особо важен для пациентов, так как многие исследования показывают, что его недостаток в организме, приводит к более тяжелому течению заболевания. Следует придерживаться рекомендуемой ежедневной дозы в 600 МЕ. поддерживать уровень данного витамина на необходимой планке.
- Иммуноглобулины при рассеянном склерозе применяются при лечении первично-прогрессирующих и вторично-прогрессирующих заболеваний РС. Главные положительные качества, которые имеют иммуноглобулины, является простота применения, хорошая переносимость и безопасность в применении. Поэтому на сегодняшний день иммуноглобулины широко используются в медицине.
Также для лечения возрастной группы пациентов применяется абаджио, рассеянный склероз с данным лекарством способен значительно снизить свою прогрессию.
Эндолимфатическая терапия при рассеянном склерозе
Схема лечения подходит для рецидивирующего заболевания, и основывается на введении лекарственных препаратов непосредственно в лимфоток человека, болеющего Р.С.
Катетер небольших размеров вводится в крупные лимфатические сосуды, после чего к устройству подсоединяются специальный дозатор (инфузомат).
Типы терапии:1. Левина ― введение в ткани.2. Интранодулярный ― пункция лимфоузла.3. Паранодулярный ― ввод лекарства в область, прилегающую к лимфоузлам.4. Лимфососудистая ― введение в сосуд.
Преимущества:• увеличение концентраций препаратов в системе лимфотока;• продление срока действия активных фармакологических веществ, введенных в организм пациентов ранее;• оперативность доставки действующего вещества к головному мозгу;• максимизация анестезирующего эффекта;• торможение разрушения миелиновых оболочек.
Примечания: список достоинств сформирован на основе результатов сравнения с действием лекарств, вводимых в/в или в/м.
Методики проведения пульс-терапии метипредом
Повреждение нервных стволов.
«Постинъекционное» обострение (микрокристаллический синовит).
Маточное кровотечение, панкреатит, повышение глюкозы крови.
Эритема, ощущение жара, потливость, головная боль.
Концепция стероидной артропатии основывается главным образом на результатах экспериментальных исследований и, как правило, связана со слишком частым введением ГК (чаще 1 раза в месяц).
При тщательном соблюдении асептики и антисептики септический артрит встречается очень редко (1 случай на 46 000 инъекций).
Имеются данные о том, что после введения ГК прочность сухожилий снижается на 40%. Поэтому в связи с риском разрыва сухожилий, лучше не вводить ГК в область воспаленных сухожилий, особенно спортсменам. Хотя отечественные авторы не приводят данных о случаях разрыва сухожилий после введения ГК по поводу тенденитов.
Другие возможные осложнения связаны с атрофией мягких тканей, особенно часто после введения ГК в мелкие суставы. Описано образование кальцинатов в месте перфорации тканей иглой.
Иногда после внутрисуставных инъекций наблюдается развитие так называемых постинъекционных обострений. Это проявляется нарастанием признаков местного воспаления через несколько часов (максимально через 48) после введения препарата. Усиление местного воспаления может быть связано с кристаллическими свойствами препарата или эффектом консервантов, входящих в состав суспензии.
Практически у всех ГК вводимых внутрисуставно наблюдается и системный эффект, что проявляется уменьшением признаков воспаления в суставах в которые ГК не вводились. Очень редко наблюдаются другие системные эффекты: эозинофилия, лимфопения, у больных сахарным диабетом повышение глюкозы. Описано маточное кровотечение, развитие панкреатита, повышение АД.
Непосредственным эффектом введения ГК может быть эритема лица, ощущение жара, потливость, головная боль, которые встречаются у 10% больных.
НЕКОТОРЫХ РЕВМАТИЧЕСКИХ ЗАБОЛЕВАНИЯХ
Системное применение ГК является одним из наиболее эффективных методов фармакотерапии ряда ревматических заболеваний (табл. 13).
В системном лечении ГК при ревматических заболеваниях в активную фазу болезни условно выделяют 5 основных фаз:
1. Индукция ремиссии: ГК короткого действия (преднизолон или метилпреднизолон) в дозе примерно соответствующей 1 мк/кг/сут с 8 часовым интервалом.
2. Консолидация: переход на однократный прием всей дозы ГК в утренние часы
3. Снижение дозы: скорость снижения зависит от дозы; возможен переход на альтернирующую терапию
4. Поддерживающее лечение: минимально эффективная доза препарата
5. Профилактика осложнений ГК-терапии (начинается с фазы индукции).
Основные показания к системному применению глюкокортикостероидов при ревматических заболеваниях
Моноклональная терапия при рассеянном склерозе
Терапевтические манипуляции предполагают введение моноклональных антител.
Запатентованные названия препаратов:1. Натализумаб (Тизабри) ― один из видов антагонистов интегрина-альфа-4.
Побочные эффекты:• повышенная утомляемость;• головные боли;• инфекционные заболевания дыхательных путей;• инфекции мочеполовой системы;• высыпания;• диареи;• анафилактические реакции.
2. Алемтузумаб (Лемтрада) ― антитело дифференцированного гликопротеина. Курсовое лечение запускает процессы разрушения лимфоцитов с последующим восстановлением клеток в течение 6-12 мес. Назначают с целью проведения монотерапии или в случае наличия противопоказаний к лечению Натализумабом.
Инновационный препарат Алемтузумаб для лечения рассеянного склероза
Зачем нужно это новое лекарство? Для каждого пациента на этот вопрос сможет развернуто ответить опытный врач-невролог. Представляя группу противоопухолевых растворов, Алемтузумаб был создан на базе моноклонального антитела.
Его разработали в США (Кембриджский университет) еще в конце 70-х г. прошлого века. Лекарственный препарат назначается врачами для эффективного воздействия на лейкоциты, что поражены раком и портят кровь. Лекарство рекомендовано при хронических проявлениях рассеянного склероза, назначается в неврологической клинике.
Относится к экспериментальным разработкам, содержащим моноклональные антитела. Применяется в лечении рассеянного склероза, характеризующегося рецидивирующе-ремиттирующим состоянием больного.
Этот вид РС (рассеянного склероза) отличается волнообразным протеканием периодов обострения. Поэтому, выбирая для снижения очагов воспаления в ЦНС наиболее действенные препараты, не стоит забывать и об инновационных разработках из этой группы лекарств.
Фармакологическое воздействие Кэмпас
Согласно статистике и научным публикациям, рассматриваемый лекарственный препарат способен значительно сокращать численность рецидивов. При терапии, которая строится на основе этого средства, болезнь отступает на 75% чаще, если сравнивать действие обычных средств на основе бета-интерферона.
Вероятность утратить трудоспособность при дозированном потреблении Алемтузумаба на ¾ ниже, в сравнении с традиционными методами лечения.
Пациенты, проходящие лечение препаратом в системе, спустя 3 года, восстанавливают некоторые функции, которые были ранее утрачены безвозвратно.
Больные, по результатам проведенных исследований, становятся более активными и здоровее от тех клиентов, которым пришлось получать традиционную терапию (бета-интерферон). У последних зафиксированы прогрессирующие нарушения с последующей утратой активности.
Сведения о состоянии клиентов подтверждаются сканированием полушарий, где показано, что пациенты, получавшие дозы Алемтузумаба, имеют увеличенный в размерах мозг, а оставшиеся больные, характеризуются уменьшенными размерами полушарий.
Исследователи констатируют факт того, что системное применение препарата способствует эффективному восстановлению нарушенных участков в мозге.
Фармакокинетические свойства
В международной системе этот состав именуется как Alemtuzumab. Первичная одноразовая в/в инфузия составляет 75 мг действующего вещества. Результатов можно добиться только от нужной дозировки вводимого внутривенно лекарства.
Концентрацию лекарства увеличивают через каждый месяц терапии. К средине второго месяца (6 нед.) достигаются стабильные показатели с повышенной концентрацией ингредиента в сыворотке. Это способствует понижению лимфоцитоза, активированного на основе опухолевых процессов.
Пациента, страдающие от нарушений памяти, расстройств, у которых в крови более 30000/мкл лейкоцитов, характеризуются пиком концентрации препарата, выраженным лейкоцитозом.
В первые 1,5 мес. лечения, эффект препарата значительно ниже, если сравнивать с пациентами, у которых количество лимфоцитов не превышает 30000/мкл.
При повышенной концентрации лимфоцитов (малигнизированных) формируется пул клеток крови, где скапливается этот состав лекарства.
Значительное понижение лимфоцитоза элиминирует пул, одновременно увеличивая показатели Cmin и Cmax вводимого средства в сыворотке. Разброс в характеристиках фармакокинетических данных подтвержден различием в образованиях опухоли.
Состав средства
Растворы средства могут быть бесцветными или иметь светлую желтую структуру, выпускаются в фармации прозрачными и опалесцирующими веществами. В розничной продаже представлен концентрат. Применяется лекарство при приготовлении раствора инфузии 1 мл Алемтузумаб. Используется 10 мг препарата и 30 мг дополнительных веществ.
Состав представлен:
- динатрием эдетата;
- фосфатным солевым буфером с составляющими: хлорида калий, дигидрофосфата калий, натрия хлорид, натрия фосфат двухосновный, полисорбат 80, вода (для инъекции).
Выпускается для продажи в ампулах по 3 мл (10 мг/мл), флаконах по 1 мл (30 мг/мл) с упаковкой по 3 ед.
Механизм действия
Препарат Провоцирует лизис лимфоцитов, напрямую взаимодействуя с CD52 (антиген), что не подвергается модуляции, способен экспрессироваться на В- и Т-лимфоцитах, включая моноциты, тимоциты и макрофаги.
При кризе лимфоцитов, где оказывают косвенное воздействие антитела, отмечается фиксация комплемента, антитело-зависимый цитотоксический клеточный эффект. Специфический антиген найден на несущественной части гранулоцита (до 5%), не поражает тромбоциты, эритроциты. Лекарство щадит стволовые кроветворные клетки, предшественниц.
Показания и противопоказания к применению
Алемтузумаб рекомендуется к применению в дозировке – 1 раз/нед. (в/в инфузия) для лечения рассеянного склероза, с предельным дозированием от 3 мг. Количество увеличивают в соответствии с назначенной схемой лечения, длящегося на протяжении не более 2 месяцев.
Среди прямых ограничений для применения средства Кэмпас выделяют:
- для женщин – период кормления малыша;
- гиперчувствительность при анафилактических реа-х, проявлениях на принимаемый в системе препарат;
- при аллергии на мышиный белок, другие вещества, что присутствуют в составе лекарства;
- острая форма непереносимости лекарства;
- обострения в системном процессе инфекционного хронического расстройства;
- наличие ВИЧ;
- злокачественные образования, опухоли;
- состояние беременности.
За дозировками обратитесь к врачу!
Средство новое и сложное в применении, а значит дозировки и схему терапии нужно узнать у лечащего врача, который сможет проконтролировать состояние пациента, грамотно назначить курс лечения.
Важно иметь значительный опыт в проведении противоопухолевой терапии, тогда дозировку и способ применения этого ингредиента будет не сложно определить.
Многое зависит от формы выпуска, а также диагностики сопутствующих болезней, степени запущенности выявленного рецидива.
При лечении этим лекарством – тщательно контролируется клиника пожилых пациентов.
Передозировка и дополнительные указания
Рассматривая побочные эффекты лекарства, эксперты констатируют, что у больных, получивших повторную дозу до объема в 240 мг, отмечается передозировка. В таких ситуациях фиксируют:
- артериальную гипотензию;
- признаки лихорадки;
- значительную анемию (III–IV ст., отсчет по NCI).
Признаки передозировки могут характеризоваться проявлениями лихорадки, аллергическими реакциями организма. В таких ситуациях отменяется прием препарата, специфического антидота не выявлено.
Возможные аналоги (заменители)
Кэмпас Показать все аналоги препарата Лемтрада » Внимание: применение аналогов должно быть согласовано с лечащим врачом.
Действующее вещество, группа
Алемтузумаб (Alemtuzumab), МИБП-антитела моноклональные
Лекарственная форма
Концентрат для приготовления раствора для инфузий
Как применять: дозировка и курс лечения
В/в инфузионно, в течение не менее 2 ч.
В первую неделю лечения назначают в возрастающих дозах – 3 мг – в 1-й день, 10 мг – во 2-й день и 30 мг в 3-й день при условии хорошей переносимости каждой дозы. Далее – 30 мг в день 3 раза в неделю (через день). Максимальная продолжительность лечения – 12 нед.
У большинства больных увеличение дозы препарата до 30 мг может быть осуществлено в течение 3-7 дней.
Однако при развитии тяжелых побочных реакций (особенно снижении АД, озноба, лихорадки или бронхоспазма) как при дозе 3 мг, так и 10 мг, следующая суточная доза препарата должна быть такой же и не должна увеличиваться до тех пор, пока переносимость препарата не станет удовлетворительной.
Источник: //yazdorov.win/nevralgiya/innovatsionnyj-preparat-alemtuzumab-dlya-lecheniya-rasseyannogo-skleroza.html
Патогенетическая терапия при рассеянном склерозе
Суть метода заключается в назначении медикаментов, которые помогают притормозить развитие патологических процессов в центральной нервной системе. К такой категории препаратов относятся ПИТРС второй и первой линий.
Научно доказано, что даже в период ремиссии продолжает разрушаться миелин в проводниках нервных импульсов, что негативно сказывается на работе головного мозга.
Поэтому, для сохранения и закрепления терапевтического эффекта, лекарства принимаются и в периоды облегчений. Стандартная схема приема ― через один день. Дозировка назначается и корректируется лечащим неврологом.
Определение
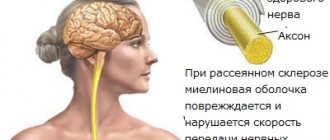
Рассеянный склероз (РС) — это хроническое нейроиммунологическое (затрагивается как нервная, так и иммунная системы) аутоиммунное расстройство, вовлекающее головной мозг, спинной мозг и периферические нервы. С помощью механизма, который не совсем понятен, разрушается защитное изолирующее вещество, называемое миелиновой оболочкой, которая покрывает нерв.
Название «рассеянный склероз» заболевание получило потому, что воспалительные приступы, которые вызывают характерные рубцы (бляшки или пятна) миелиновой оболочки, проявляются непредсказуемо, различаются по интенсивности и возникают в разных участках нервной системы.
Течение болезни приступообразное — периоды обострения сменяются периодами ремиссии. Случайность места очередного повреждения может привести к широкому спектру неврологических симптомов, которые могут изменяться от человека к человеку. Недавно стало известно, что сами нервные волокна (аксоны), в дополнение к миелиновым оболочкам, также поражаются на ранних стадиях процесса заболевания.
Без лечения болезнь в течение нескольких лет приводит к стойкой инвалидности.