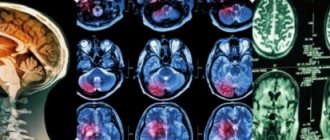
Диффузное аксональное повреждение наблюдается почти у половины пациентов с тяжелой черепно-мозговой травмой, при которой резкое ускорение либо торможение головы, например, в момент ДТП, приводит к натяжению и разрыву аксонов.
Патоморфологически диффузно-аксональное повреждение головного мозга характеризуется распространёнными первичными и вторичными разрывами аксонов (с ретракционными шарами, скоплениями микроглии, выраженной реакцией астроглии) в семиовальном центре, подкорковых образованиях, мозолистом теле, стволе мозга, а также точечными и мелкоочаговыми кровоизлияниями в этих же структурах.
Диффузное аксональное повреждение головного мозга характеризуется длительным многосуточным коматозным состоянием с момента травмы. На этом фоне выражена стволовая симптоматика (разное стояние глаз по вертикальной оси, грубый парез рефлекторного взора вверх, угнетение или выпадение реакции зрачков на свет с обеих сторон и др.).
Часто наблюдают грубые изменения частоты и ритма дыхания.
пичны позные реакции: кома сопровождается симметричной или асимметричной децеребрацией или декортикацией, как спонтанными, так и легко провоцируемыми болевыми и другими раздражителями. При этом чрезвычайно изменчив мышечный тонус, что преимущественно проявляется в виде горметонии или диффузной гипотонии. Часто обнаруживают парезы конечностей пирамидно-экстрапирамидного характера, включая и двигательные тетрасиндромы. Ярко выражены вегетативные расстройства: артериальная гипертензия, гипертермия, гипергидроз, гиперсаливация и др.
Характерная особенность клинического течения диффузного аксонального повреждения головного мозга — переход из длительной комы в стойкое или транзиторное вегетативное состояние, о наступлении которого свидетельствует открывание глаз спонтанно или в ответ на различные раздражения, но при этом нет признаков слежения, фиксации взора и выполнения элементарных инструкций. Вегетативные состояния длятся от нескольких суток до нескольких месяцев с развёртыванием нового класса неврологических признаков — симптомов функционального (или анатомического) разобщения больших полушарий и подкорково-стволовых структур мозга. Наблюдают растормаживание подкорковых, орально-стволовых и спинальных механизмов. Хаотичная и мозаичная автономизация их деятельности обусловливает появление необычных, разнообразных глазодвигательных, зрачковых, оральных, бульбарных пирамидных и экстрапирамидных феноменов. Восстанавливается живая реакция зрачков на свет; хотя анизокория может сохраняться, но преобладает сужение зрачков с обеих сторон, нередко с изменчивым их спонтанным или (как реакция на световое раздражение) парадоксальным расширением. Болевые и особенно позные раздражения иногда приводят к тоническому сведению глаз и появлению крупного конвергирующего нистагма.
Часто выражены лицевые синкинезии — жевание, сосание, причмокивание, скрежет зубами, зажмуривание век, мигание. Наблюдают глотательные и зевательные автоматизмы.
В клинической картине стойких вегетативных состояний вследствие диффузного аксонального повреждения головного мозга наряду с активизацией спинальных автоматизмов проявляются и признаки полиневропатии спинномозгового и корешкового генеза (фибрилляция мускулатуры конечностей и туловища, гипотрофия мышц кисти, распространённые нейротрофические расстройства).
По мере выхода из вегетативного состояния неврологические симптомы разобщения сменяются преобладанием симптомов выпадения. Среди них доминирует экстрапирамидный синдром с выраженной скованностью, дискоординацией, брадикинезией, олигофазией, гипомимией, мелкими гиперкинезами, атаксической походкой. Одновременно чётко проявляются нарушения психики. Среди них наиболее характерны спонтанность (с безразличием к окружающему, неопрятностью в постели, отсутствием любой активной деятельноети), амнестическая спутанность, слабоумие; при этом наблюдают грубые аффективные состояния в виде гневливости, агрессивности, раздражительности.
КТ при диффузном аксональном повреждении головного мозга показывает общее увеличение объёма мозга (вследствие его отёка и набухания), сужение или полное сдавление боковых и III желудочков, субарахноидальных конвексиальных пространств и цистерн основания мозга. На этом фоне могут быть выявлены мелкоочаговые геморрагии в белом веществе полушарий мозга, мозолистом теле, а также в подкорковых и стволовых структурах.
При развитии вегетативного состояния часто отмечается характерная динамика компьютерно-томографических данных: спустя 2— 3 нед. после травмы явления отека и набухания мозга регрессируют, мелкие очаги повышенной плотности (геморрагии) либо не визуализируются, либо плотность их становится пониженной, начинают отчетливо вырисовываться цистерны основания мозга, конвекситальные субарахноидальные щели, отмечается тенденция к расширению (ранее суженной) желудочковой системы. Обычно по времени это совпадает с переходом больных из комы в вегетативное состояние.
Источник: StudFiles.net
Течение патологического процесса
Вместе с диффузным аксональным повреждением наступает продолжительное коматозное состояние, которое сопровождается острыми изменениями мышечного тонуса (от резкого снижения до спонтанного, приступообразного повышения в конечностях).
При поражении стволового участка отмечаются следующие симптомы диффузного аксонального повреждения головного мозга:
При травмах, возникающих в результате сил ускорения и замедления, воздействие черепа на внешние структуры необязательно. Поскольку мозг и черепная полость имеют разную плотность, при воздействии одинаковых сил инерции, они реагируют неравномерно. Это несоответствие движений может способствовать разрыву мозговых вен, приводящих к дуральным синусам, а также удалению и разрыву паренхимы против жестких структур черепа. В дополнение к этому механизму, поскольку центральная область мозга относительно фиксирована из-за наличия мозгового ствола, периферические области мозга и мозжечка имеют тенденцию к большему диапазону движения.
- фиксированный взор вверх;
- ослабление или отсутствие рефлекса в ответ на раздражение глазной оболочки;
- угнетение окулоцефалического рефлекса и т. д.
Состояние практически всегда сопровождается менингеальным синдромом (неэластичность мышц шеи, непереносимость раздражителей, парезы).
Ярко выражены вегетативные нарушения:
Эта разница в диапазоне движений между центральной и периферической областями мозга вызывает растяжение аксонов и сосудов головного мозга, что может быть следствием временной дисфункции разрыва этих структур 9, 10. Вторичные поражения происходят из-за агрессий, которые начинаются после момента аварии, возникающих в результате взаимодействия внутри и внелобных факторов, которые складываются, чтобы предотвратить выживание энцефальных клеток, избавленных от первоначальной травмы. На месте несчастного случая основными факторами вторичной травмы являются клинические взаимосвязи, такие как гипотония, гипогликемия, гиперкарбия, респираторная гипоксия, анемическая гипоксия и гидроэлектролитические расстройства.
- перегрев, вызванный накоплением избыточного тепла в организме;
- повышенное потоотделение;
- повышенное слюноотделение;
- нарушение дыхательной функции, требующее подключения аппарата искусственной вентиляции легких.
Для клинического течения ДАП характерны частые переходы из коматозного состояния в устойчивое или временное вегетативное. Об этом свидетельствует самопроизвольное открывание глаз или вынужденное (в ответ на раздражитель). Признаки слежения или фиксирования взгляда при этом отсутствуют.
Наконец, существуют механизмы клеточной, нейронной, эндотелиальной и глиальной смерти из-за ионных и биохимических нарушений, которые связаны как с первичным, так и с вторичным поражением. Понимание этих механизмов имеет важное значение для изучения клинических и фармакологических подходов, которые использовались в последние годы.
В настоящее время известны два механизма гибели клеток, апоптоза и некроза. Методы идентификации этих структур в гистологических срезах широко использовались в последние годы. Апоптоз — это морфологическое проявление запрограммированной смерти, используемое в физиологических ситуациях, как в процессе созревания нервной системы, в котором нейроны, которые не развивают соответствующие синапсы, отбрасываются. 16 Гибель клеток апоптозом имеет то преимущество, что вызывает небольшую воспалительную реакцию. который минимизирует повреждение тканей; с другой стороны, поскольку это физиологический механизм, он расходует энергию.
Вегетативные нарушения при ДАП могут продолжаться несколько дней или месяцев, в некоторых случаях – даже лет. К ним постепенно присоединяются новые классы неврологических признаков – симптомы функционального или анатомического изолирования больших полушарий и подкорково-стволовых структур. Это обуславливает возникновение хаотичных, неконтролируемых глазодвигательных, языкоглоточных и других феноменов.
С другой стороны, все эти факторы также могут привести к нейроновному некрозу. В отличие от апоптоза, в котором клетка активно контролирует процесс ее разрушения, в некрозе происходит энергетический срыв, и смерть возникает из-за неспособности клетки поддерживать ее гомеостаз. Таким образом, это менее организованный процесс и включает в себя воспалительный ответ большей интенсивности вокруг него. Наиболее известными стимулами, приводящими к некрозу, являются экситотоксичность и окислительный стресс.
Экситотоксичность — это механизм, с помощью которого глутамат и другие возбуждающие нейротрансмиттеры вызывают повреждение клеток. 20 Уровни глутамата повышаются при травме через множественные пути. Во-вторых, другие факторы, такие как гипоксия, окислительный стресс и сама деполяризация, вызванная экситотоксичностью, могут нарушить контроль проницаемости мембраны и дополнительно увеличить присутствие внеклеточного глутамата. В механизмах экситотоксичности наиболее изучены ионотропные рецепторы. Повреждение клеток при экситотоксичности происходит в два этапа.
На фоне гиперрефлексии (усиления рефлексов) самопроизвольно или в ответ на раздражители отмечаются позно-тонические реакции («рефлексы положения») и нескоординированные рефлексы:
- тонические ;
- повороты головой, наклоны;
- приступообразное напряжение мышц живота;
- сгибание ноги в тазобедренном и коленном суставе в ответ на вынужденное сгибание пальцев ступни («тройное укорочение»);
- высокоамплитудные движения;
- ломаные позы рук;
- бесцельное повторение движений;
- дрожание рук.
В течение малого промежутка времени форма и сочетание таких реакций у больного многократно меняются.
Во второй момент открытие длительных каналов Са приводит к чрезмерному накоплению внутриклеточного кальция. Накопление кальция, в свою очередь, способно стимулировать активацию протеаз, фосфолипаз и оксида азота, которые вызывают ряд событий, которые приводят к гибели клеток 22.
Активация фосфолипазы А увеличивает проницаемость мембраны, генерирует образование арахидоновой кислоты и свободных радикалов. Окислительный стресс является результатом действия свободных радикалов на ткань. Свободные радикалы наносят ущерб клетке различными механизмами. Эти действия приводят к повышенной проницаемости мембран, что способствует накоплению внутриклеточного выделения кальция и глутамата.
При ДАП могут наблюдаться лицевые синкинезии (непроизвольные сокращения мышц, сопровождающие другие движения):
- жевание;
- зевание;
- глотание;
- причмокивание и т. д.
На выходе из вегетативного состояния неврологические реакции заменяют симптомы выпадения:
- экстрапирамидный синдром (избыточная или недостаточная двигательная активность, в данном случае отмечается выраженная скованность);
- нарушение координации движений;
- брадикинезия (замедление содружественных движений);
- обеднение речи;
- внезапные неконтролируемые движения групп мышц;
- походка, характерная для атаксии.
На всех стадиях течения ДАП присутствуют психические нарушения. Основные – это спутанность сознания, помрачение рассудка, амнезия. Ярко выражены физическое и психическое истощение, отсутствует побуждение к двигательной, речевой и другим формам деятельности, наблюдается (нервно-психическая слабость).
Оксид азота образуется за счет увеличения концентрации внутриклеточного кальция, связанного с механизмами клеточной агрессии, присутствующими в травме. Диффузные поражения — это те, которые влияют на мозг в целом и обычно являются результатом кинетических сил, которые приводят к вращению энцефалона в черепной полости. Дисфункции можно обнаружить, растягивая или разрывая как аксоны, так и сосудистые структуры в отдельных областях мозга.
Мягкое сотрясение охватывает случаи с полностью обратимыми неврологическими расстройствами, без потери сознания, и их можно разделить на три подгруппы. Первая подгруппа состоит из пациентов, которые испытывают путаницу и умственную дезориентацию в течение секунд, без амнезии.
Течение болезни
Одновременно с диффузным аксональным повреждением выявляются длительные коматозные состояния, сопровождающиеся изменениями работы мышечных тканей. Тонус быстро снижается или резко повышается. Когда возникают повреждения стволового участка, выявляются такие признаки диффузного аксонального повреждения головы:
- Фиксированная фокусировка зрения на верхней точке.
- Рефлекс, отвечающий на отсутствие раздражения оболочки глаз, отсутствует.
- Снижение окулоцефалической реакции.
Такое состояние всегда возникает совместно с менингеальным синдромом. Хорошо отличаются нарушения работы вегетативной системы:
- Перегрев может наступать из-за большой концентрации тепла.
- Интенсивное потоотделение.
- Слюноотделение.
- Проблемы с дыхательной функцией. Часто пациентов подключают к устройствам искусственной вентиляции органов дыхания.
При такой болезни пациент часто впадает в кому и выходит из этого состояния. Определяется устойчивое или периодическое вегетативное. На это указывает произвольное открывание глаз. Врачи не наблюдают в таких ситуаций признаков фиксации взгляда, пациент не следит за движущимися предметами.
Длительность вегетативных расстройств может продолжаться несколько месяцев или больше года. Возникают сопутствующие симптомы. Большие полушария постепенно изолируются в плане функциональности или анатомических особенностей. Это провоцирует появление хаотичных, бесконтрольных процессов в районе глотки и языка.
Описание болезни
В целом, черепно-мозговая травма – это серьезное поражение мозга, влекущее за собой опасные (иногда необратимые) последствия для организма.
Выделяют три степени тяжести поражения:
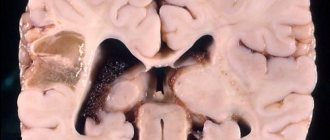
Последний тип представлен в виде масштабного поражения аксонов, сопровождающегося мозговым кровоизлиянием. Для клинической картины характерен очаг поражения на стыке белого и серого вещества. Мелкие кровоизлияния обнаруживаются в мозолистом теле, полуовальном отделе, верхней части ствола.
Во втором случае у пациентов развивается ретроградная амнезия в течение пяти-десяти минут, а у третьей подгруппы пациенты развивают ретроградную и антероградную амнезию. Однако травма развивается и начинается только после последовательности событий, которая может длиться часами. Существует блокировка в аксональном транспорте, вызванная повреждением внутриклеточных структур, что приводит к возникновению местного отека и, наконец, разрыву аксонов 31.
При диффузных поражениях головной мозг набухал в течение многих лет из-за потери контроля над сосудистыми тонерами. Считалось, что это приведет к неконтролируемому увеличению церебрального кровотока, что может вызвать одностороннее или двустороннее заполнение полушария. Таким образом, истинного отека не было бы, так как в междоузельном пространстве 32 не было бы накопления жидкости.
Диффузное аксональное повреждение мозга – тяжелое, крайне опасное состояние, представляющее угрозу для жизни. На фоне травмы формируются гематомы, образуются скопления ликвора (спинномозговой жидкости) в мозге вследствие нарушенного оттока. Наблюдаются отечность, вдавленные переломы. Перечисленные явления предшествуют ДАП как таковому.
Опухоль головного мозга может быть полусферической или двуполушарной, также называемой диффузной. Очаговые поражения состоят из гематом — внутри — или внемозговых или ограниченных ишемических областей, которые затрагивают только одну область головного мозга. При чисто фокальных поражениях остальная часть энцефалия, как предполагается, сохраняет сохраняющиеся свойства сохранения тканей и сосудов.
Среди очаговых поражений черепные переломы могут быть линейными или связаны с фокальным погружением. Они возникают из-за травм с низкой кинетической энергией, где есть контакт головы с жесткими внешними структурами 35. Линейные переломы обычно являются результатом травм, которые деформируют черепное хранилище, а провалы отражают более пунктуальное столкновение. Изолированные линейные переломы не вызывают повреждения головного мозга, однако они могут быть связаны с поражениями сосудистых структур, которые вызывают потенциально фатальные осложнения, такие как экстрадуральные гематомы.
Основное клиническое проявление – длительная кома, переходящая со временем в вегетативное состояние. При последнем отсутствует корковая деятельность. Это может продолжаться не один год.
Восстановить прежнее состояние мозга практически невозможно, мало кому удается вернуться к нормальной жизни. Если пациент пережил травму, ему показаны пожизненное наблюдение у специалиста и тщательный контроль над повреждением.
В случаях, когда открывается твердая оболочка, у пациента также возникает риск утечки спинномозговой жидкости, менингита и церебрального абсцесса. У детей младше одного года может быть особый тип перелома с погружением, перелом в «пинг-понг». В этом типе погружения участок крышки черепа, получающий удары, становится вогнутым, без образования костных спикул.
Экстрадуральная гематома, в большинстве случаев, является результатом краниального удара с низкой кинетической энергией. Для того, чтобы кровотечение произошло, необходимо разрывать сосудистые структуры, расположенные в эпидуральном пространстве, что обычно происходит вдоль линий разлома.
Диагностика
Диагностика диффузного аксонального повреждения головного мозга основана на биомеханике черепно-мозговой травмы и описании клинической картины. Анализ биомеханики ЧМТ дает возможность предположить различные варианты и степени тяжести первичного поражения мозга, а также спрогнозировать развитее вторичных повреждающих механизмов.
Однако острая субдуральная гематома связана с механизмами ускорения и замедления травм с высокой кинетической энергией и, подобно диффузным церебральным поражениям, не требует контакта черепа с внешними структурами, которые должны быть сгенерированы 41. Наличие крови в субдуральном пространстве, в тесном контакте с корой, может вызвать вторичные поражения, связанные с экситотоксичностью 42.
Ушиб мозга состоит из геморрагических областей вокруг небольших сосудов и некротической ткани головного мозга. Обычно кровотечение начинается на поверхности спинов, где происходит наибольшее трение между мозгом и жесткими структурами черепа. Механизмы образования ушибов могут быть связаны с прямой агрессией паренхимы, как в случае переломов с черепно-мозговым током, или движением энцефалона внутри краниального ящика, что может привести к дроблению паренхимы к основанию черепа или других жестких структур, При разрыве пиамара контузия называется разрывом.
Данные компьютерной томографии на острой стадии ДАП характеризуются умеренным или сильным увеличением объема мозга, суживанием или сдавливанием боковых пространств и основания мозга. Плотность ткани чаще остается в норме, но может отмечаться ее снижение или повышение.
В белом веществе, мозолистом теле и стволовых отделах часто обнаруживаются мелкоочаговые скопления крови. Динамика компьютерной томографии у пациентов с ДАП характеризуется стремительным развитием симптомов дегенеративного процесса.
Через 3-4 недели после получения травмы выявляются сгустки спинномозговой жидкости в лобных областях и меж полушарий, которые могут исчезнуть по мере нормализации психоневрологического состояния.
Электроэнцефалография при ДАП характеризуется стойкими или временными изменениями подкорковых или стволовых структур. При электроэнцефалографии часто выявляются признаки диэнцефального синдрома.
Соматосенсорные вызванные потенциалы представляют собой реакцию нервных структур при стимуляции током. При ДАП их соотносят со степенью тяжести травмы. Восстановление ССВЗ может занимать от нескольких месяцев до года (и большее), указывая на регенерационный процесс.
Характерная черта реакции нейромедиаторов при ДАП – длительное повышение концентрации серотонина с угнетением выделения дофамина и активацией адреналина. Это может стать основанием для использования в комплексной терапии препаратов, нацеленных на сдерживание реакций симпатико-адреналиновой системы.
По результатам компьютерной томографии можно примерно предположить наличие или отсутствие внутричерепного давления. Вероятность внутричерепного давления высока при отсутствии визуализации во время исследования третьего желудочка и цистерны основания мозга, либо если есть признаки их сдавливания. В таком случае может быть подключен датчик для определения и корректировки внутричерепного давления.
Если компьютерная томография показывает сохранность путей оттока ликвора (третьего желудочка и базальных цистерн), внутричерепное давление, скорее всего, остается в норме. Вероятность пользы от мер, направленных на его понижение, в таком случае низка. Информативность исследования может быть снижена при наличии осложнений.
Острый респираторный дистресс-синдром: симптомы, диагностика, лечение
- Острое начало (в течение 1 недели)
- Двусторонние затемнения на рентгене органов грудной клетки
- Соотношение PaO₂/FiO₂ (артериальный к вдыхаемому кислороду) ≤300 на положительном давлении в конце выдоха (PEEP) или непрерывном положительном давлении в дыхательных путях (CPAP) ≥5 см H₂O.
Если нет факторов риска для ОРДС, то следует исключить острый отек легких в результате сердечной недостаточности.
Этиология
Много различных состояний могут привести к ОРДС, хотя сепсис является наиболее распространенной причиной, обычно легочного происхождения (например, пневмония). Другие состояния, связанные с ОРДС включают аспирацию, ингаляционные травмы, острый панкреатит, травмы, ожоги, ушиб легких, повреждение легких после гемотрансфузий, искусственное кровообращение, жировую эмболию, распространенную внутрисосудистую коагуляцию, и данные о передозировке препаратами.
Патофизиология
Патофизиология ОРДС является сложной и не полностью изученной. В начале развития ОРДС первичным патологическим звеном является диффузное альвеолярное повреждение, хотя это не выражено одинаково у всех больных. Диффузное альвеолярное повреждение приводит к повреждению альвеолярно-капиллярной мембраны, состоящей из альвеолярных пневмоцитов I и II типа и капиллярных эндотелиальных клеток. Затем альвеолярные воздушные пространства наполняются белковой средой, воспалительными клетками (нейтрофилами и активированными альвеолярными макрофагами) и воспалительными медиаторами, включая провоспалительные цитокины, липидные медиаторы и окислители. Эпителиальная травма может быть тяжелой,с некрозом и отшелушиванием клеток I типа, обнажающих базальную мембрану.
Осаждение фибрина происходит вдоль оголенной базальной мембраны, что приводит к гиалиновым мембранам, которые характерны для диффузного альвеолярного повреждения. Повреждение клеток типа II и наводнение альвеол вносят свой вклад в дисфункцию сурфактанта. Далее, механическая вентиляция с высоким давлением и высокими объемами может нанести вред легким, способствуя каскаду провоспалительных цитокинов. На ранней стадии ОРДС клинически проявляется как гипоксемическая острая дыхательная недостаточность с повышением альвеолярноартериального кислородного градиента и плохого комплаенса легких.
Одновременно может возникнуть полиорганная недостаточность, особенно если основной причиной ОРДС является сепсис. Дисфункция правого желудочка также является распространенной и связана с худшим исходом. После острого начала альвеолярного отека и воспаления у некоторых пациентов происходит быстрое разрешение и возвращение к нормальной гистологии и функции легких.
Жидкость, составляющая отек легких, очищается активным транспортом натрия и хлорида через альвеолярный эпителий. У других пациентов, ранняя экссудативная воспалительная стадия прогрессирует в фибропролиферативную фазу. На этом более позднем этапе в легком развивается организованная фиброзная ткань и происходит осаждение коллагена, что приводит к необратимому и иногда катастрофическому фиброзу легких. Эта фаза характеризуется постоянной дыхательной недостаточностью, высокой минутной вентиляцией и плохим комплаенсом легких.
Диагностика
Поскольку диагноз ОРДС основан на клинических критериях, а не на патологическом диагнозе, вариант ОРДС следует рассматривать у всех пациентов с тяжелыми заболеваниями. Около 40% пациентов, которые удовлетворяют критериям для ОРДС, никогда не ставят диагноз.
Если у пациентов появляются двусторонние инфильтраты на рентгеновских снимках грудной клетки, у них может быть или развиваться ОРДС Важность оценки пациентов по поводу развития ОРДС обусловлена прежде всего преимуществами выживания, полученными при вентиляции с низким дыхательным объемом и ограничением вентиляции по давлению.
Анамнез
История должна быть направлена на определение наличия основного состояния, связанного с ОРДС, такого как сепсис, пневмония, аспирация содержимого желудка, панкреатит, переливание крови или тяжелая травма. Основная причина может быть важным фактором, определяющим результат; пациенты с ОРДС в связи с сепсисом, как правило, имеют самую высокую смертность. Специфические методы лечения, направленные на основную причину, оправданы с особым вниманием к идентификации и лечению источника в контексте сепсиса.
Симптомы, которые указывают на ОРДС, включают острое начало одышки и гипоксию, приводящую к острой дыхательной недостаточности, и кашель с отхаркиванием пенистой мокроты (признаком отека легких). История также должна содержать информацию, которая помогла бы предположить альтернативный ОРДС диагноз, такой как отек легких, вторичный по отношению к сердечной недостаточности, диффузное альвеолярное кровотечение изза легочного васкулита, коллагеновые заболевания сосудов или острая эозинофильная пневмония.
Исследование
При физикальном осмотре пациенты с ОРДС имеют острую гипоксическую дыхательную недостаточность, которая требует высоких концентраций кислорода и/или ПДКВ для поддержания сатурации кислорода> 90%. Пиковое давление вдоха и положительное давление в конце выдоха также увеличены. Аускультация легких может показать базальные или диффузные хрипы. Особое внимание следует уделять проверке на выявление источника инфекции, если подозревается, что сепсис является основной причиной ОРДС.
Основные тесты включают анализ газов артериальной крови для расчета соотношения PaO₂/ вдыхаемого кислорода. При скрининге на ОРДС можно также использовать соотношение насыщения кислородом к фракции вдыхаемого кислорода (SpO₂ / FiO₂) до тех пор, пока SpO₂ будет меньше 97% (ниже плато на кривой диссоциации оксигемоглобина). Было показано, что коэффициент SpO₂/FiO₂ 315 коррелируют с PaO₂/FiO₂ 300.
Использование коэффициента SpO₂/FiO₂ идентифицирует пациентов с аналогичными клиническими исходами,что и у пациентов с использованием соотношения PaO₂/FiO₂.
Рентгенография органов грудной клетки должна быть выполнена для поиска двусторонних инфильтратов, которые согласуются с отеком легких и не полностью объясняются ателектазом или легочным выпотом. Уровни мозгового натрийуретического пептида (МНП) следует учитывать, если сердечная недостаточность является потенциальной причиной двусторонних инфильтратов на рентгенограмме. МНП ниже, чем 100 нг/Л (100 пикограмм/мл) указывают на малую вероятность сердечной недостаточности, тогда как уровень МНП > 500 нг/Л (> 500 пикограмм/мл) указывает на то, что она вероятна. Эхокардиограмма должна быть сделана, если сердечная недостаточность по-прежнему является возможным диагнозом после того, как уровень МНП известен, особенно если нет факторов риска для ОРДС. Если МНП и эхокардиограмма являются неубедительными, катетеризация легочной артерии (для оценки конечного диастолического давления левого желудочка) может быть полезна для дифференциации сердечной недостаточности от ОРДС. Однако, рутинная катетеризация легочной артерии у всех пациентов не показана.
Для исследования наличия сепсиса следует проводить исследования культур крови, мокроты и мочи. Бронхоальвеолярный лаваж (БАЛ) или эндотрахеальная аспирация для окраски и культур по Граму также рекомендуется у пациентов с ОРДС, если есть подозрение на пневмонию и у тех, у кого нет уточненного предрасполагающего состояния.
БАЛ также может быть полезен для выявления других причин острой дыхательной недостаточности с двусторонними легочными инфильтратами, которые имитируют ОРДС, такие, как диффузное альвеолярное кровотечение или острая эозинофильная пневмония. Лучший диагностический тест — открытая биопсия легких. Она обычно не выполняется у критически больных пациентов из-за высокого риска заболеваемости и смертности, но может быть полезна при устранении продолжительной диагностической неопределенности.
Тесты на липазу и амилазу сыворотки следует проводить у пациентов с подозрением на острый панкреатит.
Компьютерная томография (КТ) грудной клетки обычно не требуется для диагностики или лечения ОРДС. Метод КТ более чувствителен, чем простой рентген, и может быть полезным в некоторых случаях для диагностики пневмонии или заболеваний легких. КТ-сканирование показало, что ОРДС влияет на паренхиму легкого гетерогенно, при этом наиболее затронуты зависимые части легкого. Тем не менее, рутинное КТ-сканирование грудной клетки при ОРДС для оценки неоднородности инфильтратов в настоящее время не показано.
Факторы риска
- Сепсис Сепсис является наиболее распространенным основной причиной ОРДС и обычно имеет легочное происхождение. Распространенность ОРДС у пациентов с сепсисом находится между 6% и 7%, но значительно выше у больных с септическим шоком. Считается, что системная активация воспаления и коагуляции приводит к косвенному повреждению альвеолярно-капиллярной мембраны.
- Аспирация желудочного содержимого является распространенной причиной ОРДС. Примерно одна треть госпитализированных пациентов с предшествующей аспирацией склонны к ОРДС. Считается, что аспирация причиняет прямой ущерб альвеолярному эпителию и альвеолярно-капиллярной мембране.
- Пневмонии от любого источника (бактериальные, вирусные, грибковые, паразитарные) являются распространенной причиной ОРДС. Полагают, что непосредственное повреждение возбудителем и воспалительным ответом на возбудитель является ответственным механизмом.
- Примерно у 7-10% пациентов с тяжелыми травмами развивается ОРДС. Потенциальные механизмы включают косвенные травмы от раннего геморрагического шок или позднее начало полиорганной недостаточности. Контузии легких увеличивают риск ОРДС, как и переломы длинных костей, аспирации и множественные переливания компонентов крови.
- Множественные переливания компонентов крови связаны с ОРДС.
- ОРДС, также известный как первичная дисфункция трансплантата, происходит у от 10% до 25% пациентов после трансплантации легких. Считается, что механизм состоит в повреждении из-за ишемической реперфузии.
- Хотя ОРДС не очень хорошо изучен, вероятно, он встречается у от 10% до 20% пациентов с острым панкреатитом. В одном исследовании лечение больных с острым панкреатитом октреотидом снизило частоту ОРДС.
- Злоупотребление алкоголем ассоциируется с увеличением числа случаев ОРДС у взрослых с септическим шоком.
- ОРДС встречается после ожогов и вдыхания дыма, заболеваемость среди механически вентилируемых больных с ожогами в одном исследовании 40%.
- ОРДС встречается после значительных эпизодов утопления (классы 3-6). Эти пациенты обычно восстанавливаются гораздо быстрее, чем с другими причинами ОРДС.
Дифференциальная диагностика
| Заболевание | Дифференциальные признаки/симптомы | Дифференциальные обследования |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Диагностические критерии
Берлинская модификация определений Американского европейского комитета консенсусов (AECC)
В 2012 году были внесены незначительные изменения в определения AECC ОРДС (называемое «Берлинским определением»). Диагноз ОРДС может быть поставлен, если пациент соответствует всем следующим критериям:
- Острое начало (в течение 1 недели от известного клинического случая)
- Двусторонние затемнения на рентгенограмме органов грудной клетки (не объяснимые выпотом, коллапсом или узлами)
- Дыхательная недостаточность, не полностью объяснимая сердечной недостаточностью или перегрузкой жидкостью (объективная оценка, такая как эхокардиограмма, рекомендована, если нет факторов риска).
Степени тяжести ОРДС
- Легкая: PaO₂/FiO₂ 200-300 с PEEP или CPAP ≥5 см H₂O
- Средняя: PaO₂/FiO₂ от 100 до 200 с PEEP ≥5 см H₂O
- Тяжелая: PaO₂/FiO₂ ≤100 с PEEP ≥5 см H₂O.
Лечение
Цели лечения пациентов с ОРДС — поддерживающая терапия и протективная стратегия вентиляции легких с использованием низких дыхательных объемов для ограничения конечного давления плато. Если подозреваемая основная причина ОРДС — инфекция, то источник следует идентифицировать и контролировать, а антибиотики начинать немедленно. В противном случае ближайшими целями являются поддержка и профилактика осложнений.
Смертность от ОРДС в основном связана не с дыхательной недостаточностью. Большинство пациентов умирают от основной причины ОРДС, вторичных инфекций, недостаточности других органов, основных сопутствующих заболеваний или осложнений длительной госпитализации.
Оксигенация и вентиляция
Насыщение кислородом должно поддерживаться между 88 % и 95 %, что обычно требует искусственной вентиляции легких с титрованием фракции вдыхаемого кислорода (FiO₂). Иногда пациенты могут проходить лечение неинвазивной вентиляцией, но частота неудач в таких случаях высока, и большинство из них потребует эндотрахеальной интубации и механической вентиляции. Раннее использование высокого потока кислорода через носовые канюли у больных с острой гипоксемической дыхательной недостаточностью может также улучшить клинические исходы, но это не было изучено в контексте ОРДС. Вентилятор-ассоциированное повреждение легких может быть ограничено использованием дыхательных объемов, ограничением по давлению плато при протективной стратегии вентиляции. Такая терапия показала снижение смертности. Дыхательный объем 4 мл/кг-8 мл/кг на прогнозируемый вес тела должен использоваться для поддержания давление вдоха < 30 см H₂O.
Прогнозируемая масса тела для мужчин рассчитывается как 50 + 0,91 × (сантиметров высоты минус 152,4), а для женщин — 45,5 ± 0,91 × (сантиметров высоты минус 152,4). Если давление плато составляет > 30 см H₂O, то, при необходимости, дыхательный объем должен быть снижен до 5 мл/кг или до 4 мл/кг.
Положительное давление в конце выдоха (PEEP) и FiO₂ следует титровать с использованием установленных таблиц титрования PEEP. Хотя использование таблиц титрования PEEP с более высокими уровнями PEEP не улучшает выживаемость, имеющиеся данные свидетельствуют о том, что более высокие уровни PEEP безопасны и могут улучшить оксигенацию у некоторых пациентов.
Индивидуальное титрование PEEP (а не использование таблицы титрования PEEP) не рекомендуется. Большое рандомизированное исследование индивидуального титрования PEEP и рекрутинг-маневра по сравнению с титрованием PEEP и FiO₂ с использованием установленных протоколов показало увеличение смертности с помощью индивидуального подхода к титрованию PEEP / рекрутинг-маневра. Прон-позиция может улучшить оксигенацию у пациентов с ОРДС и, как было показано, снижает смертность у пациентов с тяжелым ОРДС (PaO₂/FiO₂ < 150).
Учитывая потенциальные осложнения прон-позиции, в том числе отек лица, пролежни и смещение катетеров и эндотрахеальных трубок, прон-позицию следует рассматривать только у пациентов с тяжелым ОРДС (PaO₂/FiO₂ < 150).
Респираторный ацидоз, который является распространенным осложнением вентиляции с недостаточным дыхательным объемом, корригируется путем увеличения частоты дыхания. Хотя неизвестно какой уровень респираторного ацидоза вреден для пациентов с ОРДС, пермиссивная гиперкапния часто допускается из-за недостаточной вентиляции дыхательных путей. Однако тяжелая гиперкапния независимо связана с более высокой смертностью в ОИТ.
Нормокапния часто не может быть достигнута (и не должна быть целью). Клинические рекомендации рекомендуют поддерживать артериальный рН от 7,30 до 7,45, но исследования показывают, что пациенты, которые проходят пермиссивную гиперкапнию, могут переносить рН крови до 7,15. Инфузии бикарбоната могут быть назначены при pH ниже 7,15.
Рефрактерная гипоксемия
У пациентов с рефрактерной гипоксемией, несмотря на FiO₂ 1,0 и высокий уровень PEEP, следует учитывать методы для оксигенации для лечения.
- 1. Нервно-мышечный паралич
Нервно-мышечный паралич улучшает синхронность вентилятора у пациента и часто улучшает оксигенацию. В рандомизированном исследовании у пациентов с тяжелым ОРДС (соотношение PaO₂/FiO₂ < 150) 48 часов нервно-мышечного паралича с цисатракурием улучшали кислород и уменьшали смертность в скорректированном анализе без увеличения пареза, связанного с госпитализацией.
Нейромышечный паралич следует начинать, когда адекватная оксигенация (насыщение кислородом более 88 % до 95 %) не может быть достигнута, несмотря на вентиляцию с низким дыхательным объемом и адекватную седацию, особенно если есть асинхронность вентилятора и пациента. Прерывистые дозы паралитиков могут использоваться так же эффективно, как непрерывная внутривенная инфузия. Если пациент находится на непрерывной внутривенной инфузии миорелаксантов, должен быть использован нейромышечный мониторинг реакции подергивания мышечной ткани на препарат.
- 2. Ингаляционный оксид азота и ингаляционный простациклин
Ингаляционный оксид азота может улучшить оксигенацию у пациентов с ОРДС, но не повышает смертность и связан с острой почечной недостаточностью, и поэтому его следует использовать только как спасительную терапию для рефрактерной гипоксии. Ингаляционный простациклин легче вводить, чем ингаляционный оксид азота, а также он имеет потенциал для улучшения оксигенации в ОРДС посредством лучшего соответствия вентиляционно-перфузионного соотношения. Однако в настоящее время нет опубликованных крупных рандомизированных контролируемых исследований ингаляционного простациклина; таким образом, его следует использовать осторожно и только как спасительную терапию.
- 3. Экстракорпоральная мембранная оксигенация
В некоторых центрах оксигенация экстракорпоральная мембранная оксигенация (ЭКMO) используется у пациентов с глубокой рефрактерной гипоксией. В одном рандомизированном контролируемом исследовании перевод пациентов с тяжелым ОРДС в медицинский центр третичного уровня, который мог бы обеспечить ЭКMO наряду со стандартизованным подходом к клиническому лечению ОРДС, привел к улучшению результатов, хотя не все переведенные пациенты получали ЭКMO.
- 4. Высокочастотная осцилляторная вентиляция
Хотя рутинное использование высокочастотной осцилляторной вентиляции (HFOV) при ОРДС от средней до тяжелой степени, как было показано, не является полезным, или возможно вредоносным, HFOV может по-прежнему играть роль спасительной терапии для пациентов с тяжелым ОРДС и рефрактерной гипоксией, поскольку использование HFOV часто улучшает оксигенацию. Рутинное использование ВЧ ИВЛ не рекомендуется.
Консервативное внутривенное введение жидкости
Баланс жидкости пациента должен поддерживаться отрицательным или нейтральным (при условии, что пациент не пребывает в шоке). Центральная линия рекомендуется для измерения центрального венозного давления (ЦВД) с регулярными оценками баланса жидкости. Цель заключается в том, чтобы держать ЦВД < 4 см H₂O. Рутинное использование катетера легочной артерии (для измерения давления заклинивания легочной артерии) не рекомендуется, так как его введение связано с большими осложнениями, чем с центральной линией.
Консервативная стратегия введения жидкости уменьшала продолжительность механической вентиляции, но не влияла на смертность в большом клиническом исследовании у пациентов с ОРДС, которые не были в шоке.
Антимикробные препараты
У пациентов, у которых есть инфекционная причина ОРДС (например, пневмония или сепсис), важно быстро начать введения противомикробных препаратов. Эмпирические антибиотики, нацеленные на предполагаемую инфекцию, следует использовать как можно скорее после получения соответствующих посевов, включая кровь, мокроту и мочу. Противовирусные или противогрибковые препараты могут быть подходящими у пациентов с подозрением на вирусные или грибковые инфекции. Как только станут известны результаты посевов, можно будет подобрать антибиотики, которые действуют на определенный микроорганизм. Не существует никаких доказательств в поддержку использования антибиотиков у пациентов, имеющих ОРДС без инфекции.
Симптоматическая терапия
Стандартный поддерживающий уход за критически больными пациентами включает профилактику тромбоза глубоких вен, контроль уровня глюкозы в крови, профилактику стресс-индуцированного желудочно-кишечного кровотечения, гемодинамическую поддержку для поддержания среднего артериального давления > 60 мм рт. ст и переливание эритроцитов у больных с Hb < 70 г/Л (< 7 g/dL). Питание должно проводиться энтерально, если это возможно.
В крупном рандомизированном исследовании у 1000 пациентов с ОРДС низкодозированное энтеральное питание в течение первых 5 дней ОРДС имело сходные клинические результаты по сравнению с полным калорийным питанием.
Дополнительное питание с омега-3 жирными кислотами и антиоксидантами не рекомендуется. Ингаляционные или внутривенные бета-адренергические агонисты для облегчения очищения альвеолярной жидкости и разрешения отека легких не рекомендуются. Было показано, что раннее или позднее введение кортикостероидов не снижает смертность у пациентов с ОРДС, и их рутинное использование не рекомендуется.
Лечение диффузного аксонального повреждения головного мозга
Хирургическое вмешательство при ДАП не требуется, поскольку отсутствует вещество, подлежащее удалению. Пациент нуждается в продолжительной искусственной вентиляции легких (в умеренном режиме) и комплексной интенсивной терапии, включающей:
- прием ноотропных и вазоактивных медикаментов;
- поддержание обменных процессов посредством зондового и парентального питания;
- корректировку кислотно-щелочного и водно-электролитного баланса;
- осуществление действий, направленных на нормализацию осмотического и коллоидного давления;
- регулировку гомеостаза.
Если высока вероятность развития гнойно-воспалительных и легочных осложнений, назначается прием антибактериальных препаратов и иммуностимуляторов.
Допускается раннее введение лечебной физкультуры, направленной на восстановление двигательной функции, профилактику контрактур и корректировку нарушений речи.
Для нормализации деятельности центральной нервной системы и ускорения процесса выздоровления требуется длительный системный прием ноотропных и сосудистых средств, медикаментов, улучшающих обменные процессы в тканях, и нейромедиаторов (если есть показания).
Прогнозы
Тяжесть состояния пациента и исход ДАП зависят от масштабов первичного поражения аксонов и от выраженности вторичных внутричерепных факторов (отечность, нарушение обменных процессов в мозге, разбухание и т. д.). Играет роль и наличие внечерепных осложнений.
Прогноз зависит от эффективности терапии, направленной на ликвидацию вторичных механизмов повреждения мозга и развития осложнений. Чем дольше и тяжелее длится кома, тем выше риски неблагоприятного исхода и снижения шансов на восстановление.
Следует отметить, что существует возможность полного или частичного восстановления утраченных психических функций со снижением неврологических нарушений даже в случае, если пациент провел в коме длительное время, после чего еще несколько месяцев следовало вегетативное состояние.
Это свидетельствует об обратимости структурных нарушений, наступивших вследствие диффузного аксонального повреждения мозга.
Термин «диффузное аксональное повреждение головного мозга» впервые был предложен в 1982 г. J.H. Adams, а сама патология как отдельная форма черепно-мозговой травмы была впервые описана в 1956 г. S.J. Strich, который наблюдал за пациентами, находившимися и вегетативном статусе. Такой вид травмы возникает в результате ротационного ускорения-замедления, что случается при инерционных типах травмы. Это приводит к полным или частичным повреждениям (разрывам) аксонов, часто сочетающимся с мелкоочагоиымн кровоизлияниями. В большинстве случаев такие изменения в ткани мозга происходят па участках с максимальной разницей плотности мозговой ткани — на границе серого и белого вещества мозга.
Симптомы диффузного аксонального повреждения
Диффузное аксональное повреждение головного мозга характеризуется длительным коматозным состоянием, которое наступает непосредственно после травмы без светлого промежутка, симметричные или асимметричные симптомы децеребрнции (декортикации), часто — вариабельность изменений мышечного тонуса (от диффузной мышечной гипотонии до гормеотонии), грубые стволовые симптомы, менингеальный синдром. При диффузном аксональном поражении головного мозга практически всегда отмечаются грубые нарушения витальных функций, а также выраженные вегетативные изменения. Кома чаще всего трансформируется в транз и торное или стойкое вегетативное состояние, в случае выхода из которого остаются грубые симптомы выпадения (обычно доминируют экстрапирамидные симптомы и выраженные расстройства психики).
Симптомы
ДАП сопровождается продолжительным (около 2-3 недель) коматозным состоянием, при котором наблюдаются:
- стволовые симптомы – нарушение зрачковых рефлексов, парез взора, разностояние глазных яблок и другие;
- изменение дыхательного ритма;
- симметричная или асимметричная ригидность (повышенный тонус) мышц, которая провоцируется внешними раздражителями;
- парезы (снижение силы) конечностей;
- вегетативные расстройства – гипертензия, повышение температуры и прочие.
Выйдя из комы, человек с ДАП переходит в вегетативное состояние. Его признаки:
- открывание глаз в ответ на воздействие раздражителей либо спонтанно;
- отсутствие фиксации взора и слежения за предметами.
Длительность вегетативного состояния индивидуальна – от нескольких суток до 3-5 месяцев. При этом у пациента не функционирует кора головного мозга, и возникают разнообразные симптомы разобщения полушарий и ствола, в частности появляются необычные зрачковые, глазодвигательные, оральные, бульбарные и прочие рефлексы.
При значительном сроке вегетативного состояния в результате ДАП возникают признаки спинномозговой и корешковой полиневропатии:
- фибрилляция мышц;
- гипотрофия мускулов кисти;
- нейротрофические расстройства.
Также могут развиться тахикардия, гипергидроз, тахипноэ и другие вегето-висцеральные нарушения.
Выход из вегетативного состояния сопровождается появлением симптомов выпадения. Основные последствия диффузного аксонального повреждения головного мозга:
- экстрапирамидный синдром – для него характерны скованность мышц, атаксия (нарушение координации движений), гипомимия (бедность мимики), олигофазия (снижение речевой активности);
- психические расстройства – безразличие к окружающим, отсутствие побуждений к деятельности, спутанность памяти, слабоумие, агрессивность.
Диагностика диффузного аксонального повреждения
Диагностика диффузного аксонального повреждения основывается на учете биомеханики черепно-мозговой травмы, Коматозное состояние, наступившее сразу после ЧМТ, с выраженными нарушениями стволовых функций, генерализованными тоническими реакциями, симптоматикой симметричной или асимметричной децеребрации (декортикации) дает основания предполагать именно диффузное аксональное повреждение головного мозга.
Для компьютерной томограммы головного мозга при диффузном аксональном повреждении головного мозга характерно увеличение объема мозга вследствие его отека, набухания, гиперемии со сдавленней желудочков мозга и субарах-пондальных конвекситальных пространств. При этом часто выявляются мелкоочаговые геморрагии в белом веществе полушарий мозги, мозолистом теле, а также в подкорковых и стволовых структурах.
МРТ выявляет изменения, зависящие от наличия или отсутствия кровоизлияний и их давности. Частой находкой МРТ-обследований при диффузном аксональном повреждении головного мозга являются мелкоочаговые кровоизлияния в глубинных структурах субэиендимарно. Со временем интенсивность изображения этих очагов снижается.
Общая информация
Диффузное аксональное повреждение головного мозга, как правило, становится следствием инерционной черепно-мозговой травмы, то есть одностороннего центростремительного ударного воздействия на голову. При этом происходит натяжение и разрыв аксонов – отростков нервных клеток, которые передают импульсы от тела клетки к иннервируемым (управляемым) органам.
Обычно разрыв аксонов сочетается с мелкоочаговыми геморрагиями (кровоизлияниями). Сосудистые и нервные нарушения локализуются в стволе мозга, паравентрикулярных зонах, белом веществе и мозолистом теле. Патологические очаги при ДАП приводят к существенному снижению мозговой активности человека.
Лечение диффузного аксонального повреждения
Пострадавшие с диффузным аксоиальным повреждением не подлежат хирургическому лечению. Показания к операции при диффузном аксональном повреждении головного мозга возникают лишь при обнаружении сопутствующих очаговых повреждений, вызывающих с давление головного мозга. Консервативное лечение проводится в отделениях интенсивной терапии.
Пострадавшие, которые имеют диффузное аксональное повреждение головного мозга нуждаются в проведении длительной ИВЛ в режиме гипервентиляции с комплексом терапевтических мероприятий, направленных на поддержание обменных процессов с использованием энтерального и парентерального питания, коррекции нарушений кислотно-основного и водно-электролитного баланса, нормализации осмотического и коллоидного состава крови, системы гомеостаза. Для профилактики и лечения инфекционао-воспалительных осложнений назначают антибактериальные препараты с учетом чувствительности микрофлоры.