Нервная система человека и позвоночных животных имеет единый план строения и представлена центральной частью – головным и спинным мозгом, а также периферическим отделом – отходящими от центральных органов нервами, представляющими собой отростки нервных клеток – нейронов.
Их совокупность образует нервную ткань, главными функциями которой является возбудимость и проводимость. Эти её свойства объясняются прежде всего особенностями строения оболочек нейронов и их отростков, состоящих из вещества, названного миелином. В данной статье мы рассмотрим строение и функции этого соединения, а также выясним возможные способы его восстановления.
Почему нейроциты и их отростки покрыты миелином
Совсем не случайно дендриты и аксоны имеют защитный слой, состоящий из белково-липидных комплексов. Дело в том, что возбуждение является биофизическим процессом, в основе которого лежат слабые электрические импульсы. Если электрический ток идёт по проводу, то последний должен быть покрыт изоляционным материалом, чтобы уменьшить рассеивание электрических импульсов и не допустить снижение силы тока. Такие же функции в нервном волокне выполняет миелиновая оболочка. Кроме того, она является опорой, а также обеспечивает питание волокна.
Белки миелина ПНС
Миелин ПНС содержит как некоторые уникальные белки, так и несколько общих с белками миелина ЦНС белков.
Р0 — главный белок миелина ПНС, имеет молекулярную массу 30 кДа, составляет более половины белков миелина ПНС. Интересно отметить, что хотя он отличается от PLP по аминокислотной последовательности, путям посттрансляционной модификации и структуре, тем не менее оба эти белка имеют одинаково важное значение для формирования структуры миелина ЦНС и ПНС.
Содержание МВР в миелине ПНС составляет 5-18% от общего количества белка, в отличие от ЦНС, где его доля достигает трети всего белка. Те же четыре формы белка МВР с молекулярными массами 21, 18,5, 17 и 14кДа, соответственно, обнаруженные в миелине ЦНС, присутствуют и в ПНС. У взрослых грызунов МВР с молекулярной массой 14 кДа (по классификации периферийных миелиновых белков ему присвоено название «Рr») является самым значительным компонентом всех катионных белков. В миелине ПНС присутствует и МВР с молекулярной массой 18 кДа (в этом случае он носит название «белок Р1»). Следует отметить, что важность семейства белков МВР не так велика для миелиновой структуры ПНС, как для ЦНС.
Химический состав миелина
Как и большинство клеточных мембран, он имеет липопротеидную природу. Причём содержание жиров здесь очень высокое – до 75%, а белков – до 25%. Миелин в незначительном количестве содержит также гликолипиды и гликопротеиды. Химический состав его различается в спинномозговых и в черепно-мозговых нервах.
В первых наблюдается высокое содержание фосфолипидов – до 45%, а остальная часть приходится на холестерин и цереброзиды. Демиелинизация (то есть замена миелина на другие вещества в нервных отростках) приводит к таким тяжёлым аутоиммунным заболеваниям, как, например, рассеянный склероз.
С химической точки зрения, этот процесс будет выглядеть так: миелиновая оболочка нервных волокон меняет свою структуру, что проявляется прежде всего в уменьшении процентного содержания липидов по отношению к белкам. Далее снижается количество холестерина и возрастает содержание воды. А всё это приводит к постепенной замене миелина, содержащего олигодендроциты или шванновские клетки на макрофаги, астроциты и межклеточную жидкость.
Результатом таких биохимических изменений будет резкое снижение способности аксонов проводить возбуждение вплоть до полной блокировки прохождения нервных импульсов.
Белки миелина ЦНС
Белковый состав миелина ЦНС более прост, чем других мембран мозга, и представлен главным образом протеолипидами и основными белками, которые составляют 60-80% от общего количества. Гликопротеины присутствуют в гораздо меньших количествах. Миелин центральной нервной системы содержит уникальные белки.
Для миелина ЦНС человека характерно количественное превалирование двух белков: положительно заряженного катионного белка миелина (myelin basic protein, МВР) и протеолипида миелина (myelin proteolipid protein, PLP). Эти белки — главные составные части миелина ЦНС всех млекопитающих.
Миелиновый протеолипид PLP (proteolipid protein), также известный как белок Фолча, имеет способность растворяться в органических растворителях. Молекулярная масса PLP составляет приблизительно 30 кДа (Да — дальтон). Его аминокислотная последовательность чрезвычайно консервативна, молекула формирует несколько доменов. Молекула PLP включает три жирные кислоты, как правило, пальмитиновую, олеиновую и стеариновую, соединенные с аминокислотными радикалами эфирной связью.
Миелин ЦНС содержит несколько меньшие количества другого протеолипида — DM-20, названного так по его молекулярной массе (20 кДа). И анализ ДНК, и выяснение первичной структуры показали, что DM-20 образуется в результате отщепления 35 аминокислотных остатков от белка PLP. В процессе развития DM-20 появляется раньше, чем PLP (в некоторых случаях даже до появления миелина); предполагают, что в дополнение к структурной роли в образовании миелина он может участвовать в дифференцировке олигодендроцитов.
Вопреки представлениям о том, что PLP необходим для формирования компактного мультиламеллярного миелина, процесс образования миелина у мышей, «нокаутированных» по PLP/DM-20, происходит лишь с незначительными отклонениями. Однако у таких мышей уменьшена продолжительность жизни и нарушена общая подвижность. Напротив, естественно происходящие мутации в PLP, в том числе его повышенная экспрессия (normal PLP over-expression), имеют серьезные функциональные последствия. Следует отметить, что существенные количества белков PLP и DM-20 представлены в ЦНС, матричная РНК для PLP есть и в ПНС, и небольшое количество белка там синтезируется, но не включается в миелин.
Катионный белок миелина (МВР) привлекает внимание исследователей вследствие его антигенной природы — при введении животным он вызывает аутоиммунную реакцию, так называемый экспериментальный аллергический энцефаломиелит, который представляет собой модель тяжелого нейродегенеративного заболевания — рассеянного склероза.
Аминокислотная последовательность МВР у многих организмов высоко консервативна. МВР расположен на цитоплазматической стороне миелиновых мембран. Он имеет молекулярную массу 18,5 кДа и лишен признаков третичной структуры. Этот основный белок обнаруживает микрогетерогенность при электрофорезе в щелочных условиях. Большинство исследованных млекопитающих содержали различные количества изоформ МБР, имеющих существенную общую часть аминокислотной последовательности. Молекулярная масса МБР мышей и крыс — 14 кДа. МБР с малой молекулярной массой имеет такие же аминокислотные последовательности на N- и С-терминальных частях молекулы, как и остальной МБР, но отличается редукцией около 40 аминокислотных остатков. Соотношение этих основных белков изменяется в процессе развития: зрелые крысы и мыши имеют больше МБР с молекулярной массой 14кДа, чем МБР с молекулярной массой 18 кДа. Две другие изоформы МБР, также обнаруживаемые во многих организмах, имеют молекулярную массу 21,5 и 17 кДа, соответственно. Они образованы присоединением к основной структуре полипептидной последовательности массой около 3 кДа.
При электрофоретическом разделении белков миелина выявляются белки с более высокой молекулярной массой. Их количество зависит от вида организма. Например, мышь и крыса могут содержать таких белков до 30% от общего количества. Содержание этих белков также изменяется в зависимости от возраста животного: чем оно моложе, тем меньше в его мозге миелина, но тем больше в нем белков с более высокой молекулярной массой.
Фермент 2″ 3″-циклический нуклеотид З»-фосфодиэстераза (CNP) составляет несколько процентов от общего содержания миелинового белка в клетках ЦНС. Это гораздо больше, чем в других типах клеток. Белок CNP — не главный компонент компактного миелина, он сконцентрирован лишь в определенных участках миелиновой оболочки, связанной с цитоплазмой олигодендроцита. Белок локализован в цитоплазме, но часть его связана с цитоскелетом мембраны — F-актином и тубулином. Биологическая функция CNP может заключаться в регулировании структуры цитоскелета для ускорения процессов роста и дифференциации в олигодендроцитах.
Миелинассоциированный гликопротеин (MAG) — минорный в количественном отношении компонент очищенного миелина, имеет молекулярную массу 100 кДа, содержится в ЦНС в небольшом количестве (менее 1 % от общего белка). MAG имеет единственный трансмембранный домен, который отделяет сильногликозилированную внеклеточную часть молекулы, составленную из пяти подобных иммуноглобулину доменов, от внутриклеточного домена. Его полная структура подобна белку адгезии нейрональной клетки (NCAM).
MAG не присутствует в компактном, мультиламеллярном миелине, но находится в периаксональных мембранах олигодендроцитов, образующих слои миелина. Напомним, что периаксональная мембрана олигодендроцита — наиболее близко расположена к плазматической мембране аксона, но тем не менее эти две мембраны не сливаются, а разделены экстраклеточной щелью. Подобная особенность локализации MAG, а также то, что этот белок относится к иммуноглобулиновому суперсемейству, подтверждает участие его в процессах адгезии и передачи информации (сигналинга) между аксолеммой и миелинобразующими олигодендроцитами в процессе миелинизации. Кроме того, MAG — один из компонентов белого вещества ЦНС, который ингибирует рост нейритов в культуре ткани.
Из других гликопротеинов белого вещества и миелина следует отметить минорный миелинолигодендроцитарный гликопротеин (Myelin-oligodendrocytic glycoprotein, MOG). MOG является трансмембранным белком, содержащим единственный иммуноглобулинподобный домен. В отличие от MAG, который расположен во внутренних слоях миелина, MOG локализован в его поверхностных слоях, в силу чего может участвовать в передаче внеклеточной информации к олигодендроциту.
Малые количества характерных белков мембран могут быть идентифицированы в результате электрофореза на полиакриламидном геле (ПААГ) (например, тубулин). Электрофорез высокого разрешения демонстрирует наличие других незначительных полос белка; они могут быть связаны с присутствием ряда ферментов миелиновой оболочки.
Особенности нейроглиальных клеток
Как мы уже говорили, миелиновая оболочка дендритов и аксонов образована специальными структурами, характеризующимися низкой степенью проницаемости для ионов натрия и кальция, а потому имеющих только потенциалы покоя (они не могут проводить нервные импульсы и выполняют электроизоляционные функции).
Данные структуры называются глиальными клетками. К ним относятся:
- олигодендроциты;
- волокнистые астроциты;
- клетки эпендимы;
- плазматические астроциты.
Все они формируются из наружного слоя зародыша – эктодермы и имеют общее название – макроглия. Глия симпатических, парасимпатических и соматических нервов представлена шванновскими клетками (нейролеммоцитами).
Строение и функции олигодендроцитов
Они входят в состав центральной нервной системы и являются клетками макроглии. Так как миелин – это белково-липидная структура, она способствует увеличению скорости проведения возбуждения. Сами клетки образуют электроизолирующий слой нервных окончаний в головном и спинном мозге, формируясь уже в период внутриутробного развития. Их отростки обворачивают в складки своей наружной плазмалеммы нейроны, а также дендриты и аксоны. Получается, что миелин – это основной электроизолирующий материал, разграничивающий нервные отростки смешанных нервов.
Шванновские клетки и их особенности
Миелиновая оболочка нервов периферической системы образована нейролеммоцитами (шванновскими клетками). Их отличительная особенность состоит в том, что они способны образовывать защитную оболочку только одного аксона, и не могут формировать отростки, как это присуще олигодендроцитам.
Между шванновскими клетками на расстоянии 1-2 мм располагаются участки, лишённые миелина, так называемые перехваты Ранвье. По ним скачкообразно происходит проведение электрических импульсов в пределах аксона.
Леммоциты способны к репарации нервных волокон, а также выполняют трофическую функцию. В результате генетических аббераций клетки оболочки леммоцитов начинают неконтролируемое митотическое деление и рост, вследствие чего в различных отделах нервной системы развиваются опухоли – шванномы (невриномы).
Мильгамма
Мильгамма представляет собой нейропротектор для восстановления обмена веществ внутри клеток, что позволяет замедлить процесс разрушения миелина и начать его регенерацию. В основе препарата лежат витамины из группы В, а именно:
- Тиамин (В1). Он крайне необходим для усвоения сахара в организме и получения энергии. При остром дефиците тиамина у человека нарушается сон и ухудшается память. Он становится нервным, а иногда подавленным, как при депрессии. В некоторых случаях наблюдаются симптомы парестезии (мурашки по коже, уменьшение чувствительности и покалывания в кончиках пальцев);
- Пиридоксин (В6). Такой витамин играет немаловажную роль в выработке аминокислот, а также некоторых гормонов (дофамин, серотонин и т. д.). Несмотря на редкие случаи нехватки пиридоксина в организме, из-за его дефицита возможно понижение умственных способностей и ослабление иммунной защиты;
- Цианокобаломин (В12). Он служит для улучшения проводимости нервных волокон вследствие чего улучшается чувствительность, а также для улучшения синтеза крови. При нехватке цианокобаломина у человека развиваются галлюцинации, деменция (слабоумие), наблюдаются сбои в ритме сердца и парестезии.
Благодаря такому составу Мильгама способна остановить окисление клеток свободными радикалами (реактивными веществами), что повлияет на восстановление чувствительности тканей и нервных окончаний. После курса приема таблеток отмечается снижение симптоматики и улучшение общего состояния, а употреблять препарат нужно в 2 этапа.
Роль микроглии в разрушении миелиновой структуры
Микроглия представляет собой макрофаги, способные к фагоцитозу и умеющие распознавать различные патогенные частицы – антигены. Благодаря мембранным рецепторам эти глиальные клетки вырабатывают ферменты – протеазы, а также цитокины, например, интерлейкин 1. Он является медиатором воспалительного процесса и иммунитета.
Миелиновая оболочка, функции которой заключаются в изолировании осевого цилиндра и улучшении проведения нервного импульса, может повреждаться интерлейкином. В результате этого, нерв «оголяется» и скорость проведения возбуждения резко снижается.
Более того, цитокины, активируя рецепторы, провоцируют избыточный транспорт ионов кальция в тело нейрона. Протеазы и фосфолипазы начинают расщеплять органеллы и отростки нервных клеток, что приводит к апоптозу – гибели данной структуры.
Она разрушается, распадаясь на частицы, которые и пожирают макрофаги. Это явление называется эксайтотоксичностью. Оно вызывает дегенерацию нейронов и их окончаний, приводя к таким заболеваниям, как болезнь Альцгеймера и болезнь Паркинсона.
Принципы лечения дефектов оболочки
Заболевания, связанные с разрушением мякотной оболочки, очень сложно лечить. Терапия направлена в основном на купирование симптомов и остановку процессов разрушения. Чем раньше диагностировано заболевание, тем больше шансов остановить его течение.
Возможности восстановления миелина
Благодаря своевременному лечению можно запустить процесс восстановления миелина. Однако, новая миелиновая оболочка не будет так же хорошо выполнять свои функции. Кроме того, болезнь может перейти в хроническую стадию, а симптомы сохранятся, лишь слегка сгладятся. Но даже незначительная ремиелинизация способна остановить ход болезни и частично вернуть утраченные функции.
Современные лекарственные средства, направленные на регенерацию миелина более эффективны, но отличаются очень высокой стоимостью.
Терапия
Для лечения заболеваний, вызванных разрушением миелиновой оболочки, используются следующие препараты и процедуры:
- бета-интерфероны (останавливают течение заболевания, снижают риск возникновения рецидивов и инвалидности);
- иммуномодуляторы (воздействуют на активность иммунной системы);
- миорелаксанты (способствуют восстановлению двигательных функций);
- ноотропы (восстанавливают проводниковую активность);
- противовоспалительные (снимают воспалительный процесс, вызвавший разрушение миелина);
- нейропротекторы (предупреждают повреждение нейронов мозга);
- обезболивающие и противосудорожные препараты;
- витамины и антидепрессанты;
- фильтрация ликвора (процедура, направленная на очищение спинномозговой жидкости).
Мякотные нервные волокна
Если отростки нейронов – дендриты и аксоны, покрывает миелиновая оболочка, то они называются мякотными и иннервируют скелетную мускулатуру, входя в соматический отдел периферической нервной системы. Немиелинизированные волокна образуют вегетативную нервную систему и иннервируют внутренние органы.
Мякотные отростки имеют больший диаметр, чем безмякотные, и формируются следующим образом: аксоны прогибают плазматическую мембрану клеток глии и формируют линейные мезаксоны. Затем они удлиняются и шванновские клетки многократно обворачиваются вокруг аксона, образуя концентрические слои. Цитоплазма и ядро леммоцита перемещаются в область наружного слоя, который называется неврилеммой или шванновской оболочкой.
Внутренний слой леммоцита состоит из слоистого мезоксона и называется миелиновой оболочкой. Толщина её в различных участках нерва неодинакова.
Как восстановить миелиновую оболочку
Рассматривая роль микроглии в процессе демиелинизации нервов, мы установили, что под действием макрофагов и нейромедиаторов (например, интерлейкинов) происходит разрушение миелина, что в свою очередь приводит к ухудшению питания нейронов и нарушению передачи нервных импульсов по аксонам.
Данная патология провоцирует возникновение нейродегенеративных явлений: ухудшение когнитивных процессов, прежде всего памяти и мышления, появление нарушения координации движений тела и тонкой моторики.
В итоге возможна полная инвалидизация больного, которая возникает в результате аутоиммунных заболеваний. Поэтому вопрос о том, как восстановить миелин, в настоящее время стоит особенно остро. К таким способам относится прежде всего сбалансированная белково-липидная диета, правильный образ жизни, отсутствие вредных привычек. В тяжелых случаях заболеваний применяют медикаментозное лечение, восстанавливающее количество зрелых глиальных клеток – олигодендроцитов.
哈尔滨楠木南中医门诊部
источник сайт дцп — https://help-baby.org/blog/demielinizirujushhie_zabolevanija/2014-02-13-837
Демиелинизация Demyelination заболевание, вызванное избирательным повреждением миелиновой оболочки, проходящей вокруг нервных волокон
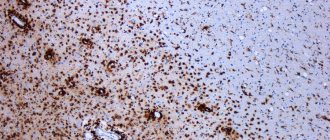
Демиелинизация — патологический процесс, при котором миелинизированные нервные волокна теряют свой изолирующий миелиновый слой. Миелин, фагоцитированный микроглией и макрофагами, а впоследствии — астроцитами, замещается фиброзной тканью (бляшками). Демиелинизация нарушает проведение импульса по проводящим путям белого вещества головного и спинного мозга; периферические нервы не поражаются.
ДЕМИЕЛИНИЗАЦИЯ — разрушение миелиновой оболочки нервных волокон в результате воспаления, ишемии, травмы, токсико-метаболических или иных расстройств.
Демиелинизация (Demyelination) — заболевание, вызванное избирательным повреждением миелиновой оболочки, проходящей вокруг нервных волокон центральной или периферической нервной системы. Это в свою очередь приводит к нарушению функций миелиновых нервных волокон. Демиелинизация может быть первичной (например, при рассеянном склерозе), или развивается после травмы черепа.
Заболевания, одним из основных проявлений которых является разрушение миелина, — одна из наиболее актуальных проблем клинической медицины, преимущественно неврологии. В последние годы наблюдается отчетливое увеличение числа случаев заболеваний, сопровождающихся повреждением миелина.
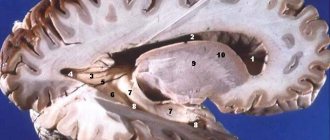
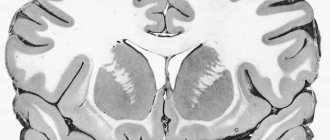
Миелин — особый вид клеточной мембраны, окружающей отростки нервных клеток, в основном аксоны, в центральной (ЦНС) и периферической нервной системе (ПНС).
Основные функции миелина: •питание аксона •изоляция и ускорение проведения нервного импульса •опорная •барьерная функции.
По химическому составу миелин — это липопротеидная мембрана, состоящая из биомолекулярного липидного слоя, расположенного между мономолекулярными слоями белков, спирально закрученная вокруг интернодального сегмента нервного волокна.
Липиды миелина представлены фосфолипидами, гликолипидами и стероидами. Все эти липиды построены по единому плану и обязательно имеют гидрофобный компонент («хвост») и гидрофильную группу («головку»).
Белки составляют до 20% сухой массы миелина. Они бывают двух видов: белки, расположенные на поверхности, и белки, погруженные в липидные слои или пронизывающие мембрану насквозь. Всего описано более 29 белков миелина. Основной белок миелина (ОБМ), протеолипидный белок (ПЛП), миелин-ассоциированный гликопротин (МАГ) составляют до 80% массы белка. Они выполняют структурную, стабилизирующую, транспортную функции, обладают выраженными иммуногенными и энцефалитогенными свойствами. Среди мелких белков миелина особое внимание заслуживает миелин-олигодендроцитарный гликопротеин (МОГ) и ферменты миелина, имеющие большое значение в поддержании структурно-функциональных взаимоотношений в миелине.
Миелины ЦНС и ПНС отличаются по своему химическому составу •в ПНС миелин синтезируется шванновскими клетками, причем несколько клеток синтезируют миелин для одного аксона. Одна шванновская клетка образует миелин только для одного сегмента между участками без миелина (перехватами Ранвье). Миелин ПНС заметно толще, чем в ЦНС. Такой миелин имеют все периферические и черепные нервы, только короткие проксимальные сегменты черепных нервов и спинно-мозговых корешков содержат миелин ЦНС. Зрительный и обонятельный нервы содержат преимущественно центральный миелин •в ЦНС миелин синтезируется олигодендроцитами, причем одна клетка принимает участие в миелинизации нескольких волокон.
Разрушение миелина является универсальным механизмом реакции нервной ткани на повреждение.
Болезни миелина подразделяются на две основные группы •миелинопатии — связаны с биохимическим дефектом строения миелина, как правило, генетически обусловленным
•миелинокластии — в основе миелинокластических (или демиелинизирующих) заболеваний лежит разрушение нормально синтезированного миелина под влиянием различных воздействий, как внешних, так и внутренних.
Подразделение на эти две группы весьма условно, так как первые клинические проявления миелинопатий могут быть связаны с воздействием различных внешних факторов, а миелинокластии вероятнее всего развиваются у предрасположенных лиц.
Наиболее распространенное заболевание из всей группы болезней миелина — рассеянный склероз. Именно с этим заболеванием приходится наиболее часто проводить дифференциальную диагностику.
Наследственные миелинопатии
Клинические проявления большинства этих заболеваний чаще отмечаются уже в детском возрасте. В то же время имеется ряд заболеваний, которые могут начинаться в более позднем возрасте.
Адренолейкодистрофии (АЛД) связаны с недостаточностью функции коры надпочечников и характеризуются активной диффузной демиелинизацией различных отделов как ЦНС, так и ПНС. Основной генетический дефект при АЛД связан с локусом на Х-хромосоме — Xq28, генетический продукт которого (белок ALD-P) является пероксисомальным мембранным белком. Тип наследования в типичных случаях — рецессивный, зависимый от пола. В настоящее время описано более 20 мутаций в разных локусах, связанных с разными клиническими вариантами АЛД.
Основной метаболический дефект при этом заболевании — увеличение содержания в тканях насыщенных жирных кислот с длинной цепью (особенно С-26), что приводит к грубым нарушениям структуры и функций миелина. Наряду с дегенеративным процессом в патогенезе болезни существенное значение имеет хроническое воспаление в ткани мозга, связанное с повышенной продукцией фактора некроза опухолей альфа (ФНО-a). Фенотип АЛД определяется активностью этого воспалительного процесса и вероятнее всего обусловлен как различным набором мутаций на Х-хромосоме, так и аутосомной модификацией влияния дефектного генетического продукта, т.е. сочетанием основного генетического дефекта в половой Х-хромосоме со своеобразным набором генов на других хромосомах.